
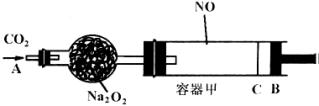
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。此时,通入标准状况下的CO2气体多少L?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入amol CO2,此时活塞恰好回至B处。则a值必小于0.0l,其理由是____ _____。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于_________g。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2011-2012学年河南省南阳一中高二第一次月选4考化学试卷(带解析) 题型:实验题
100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是 。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案) KJ/mol。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省武威市第六中学高一下学期期中测试化学试卷(带解析) 题型:实验题
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是 。装置中还存在的2个错误是①__
② 这种错误会造成最高温度读数________(填“增大”、“减小”或“无影响”);测得的中和热将____________(填“偏大”、“偏小”或“无影响”)。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
| A.盐酸的浓度 |
| B.盐酸的温度 |
| C.氢氧化钠溶液的浓度 |
| D.氢氧化钠溶液的温度 |
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省武威市高一下学期期中测试化学试卷(解析版) 题型:实验题
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是 。装置中还存在的2个错误是①__
② 这种错误会造成最高温度读数________(填“增大”、“减小”或“无影响”);测得的中和热将____________(填“偏大”、“偏小”或“无影响”)。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2013届河南省高二第一次月选4考化学试卷(解析版) 题型:实验题
100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是 。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案) KJ/mol。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com