
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
分析 A.缩小容器的体积,NO2的浓度增大,气体颜色加深;
B.消耗H2为正速率,消耗HI为逆速率,根据正逆速率的关系判断;
C.加入NH3,NH3的体积分数增大;
D.恒温恒压条件下,充入He,容器的体积增大,反应物的分压减小.
解答 解:A.缩小容器的体积,NO2的浓度增大,气体颜色加深,但是气体的压强增大,平衡逆向移动,故A错误;
B.消耗H2为正速率,消耗HI为逆速率,单位时间内消耗H2和HI的物质的量之比大于1:2,即正反应速率大于逆反应速率,所以向正反应方向移动,故B正确;
C.加入NH3,NH3的体积分数增大,NH3为生成物,增大生成物的浓度平衡逆向移动,故B错误;
D.恒温恒压条件下,充入He,容器的体积增大,反应物的分压减小,减小压强向气体体积增大的方向移动,即向逆反应方向移动,故D错误.
故选B.
点评 本题考查了化学平衡的影响因素和应用,掌握分析方法和平衡移动原理是解题关键,题目难度不大,侧重于考查学生对基本原理的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
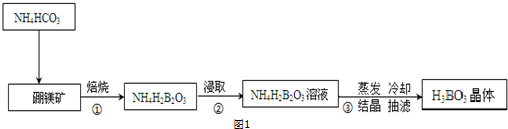
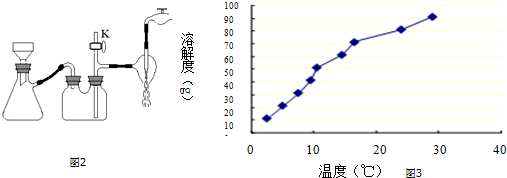
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快 | |
| B. | 反应进行的净速率是正、逆反应速率之差 | |
| C. | O2的消耗速率与SO3的生成速率之比为2:1 | |
| D. | 加入SO2,可使单位体积内活化分子百分比增多,加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
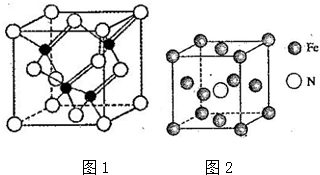
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
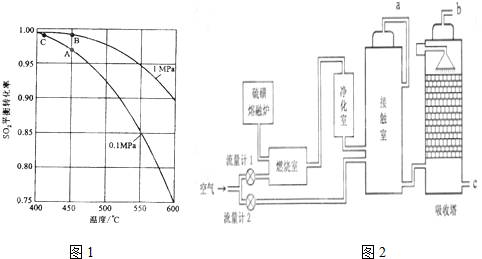
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com