
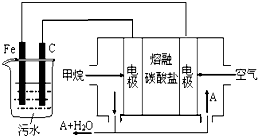
| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
分析 燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,所以电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,据此分析.
解答 解:A、电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,故A错误;
B、甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,故B错误;
C、电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2,故C正确;
D、电解时阴极反应式为2H++2e-=H2↑,产生4.48 L气体为标准状况下时,转移电子数为0.2NA,故D错误;
故选C.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△H-T△S<0 | B. | △H<0,△H-T△S>0 | C. | △H>0,△H-T△S>0 | D. | △H<0,△H-T△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
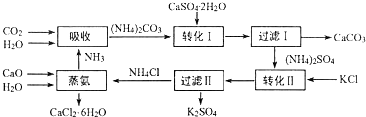
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-氯戊烷的分子式为C5H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷能发生取代反应 | D. | 3-氯戊烷的同分异构体共有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时负极反应为:3Zn-6e-═3Zn2+ | |
| B. | 放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| D. | 放电时负极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
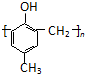 )的合成路线如下:
)的合成路线如下: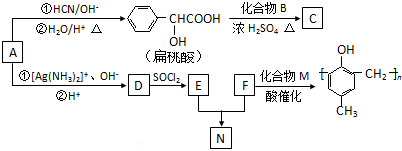
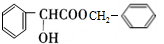 .
. .
.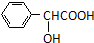 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).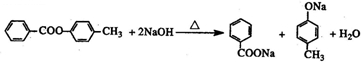 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com