
| 加入的物质 | 结论 | |
| A | 100mL 2mol•L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.20molCaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 200mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.4molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
分析 n(Na2CO3)=0.2mol,碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,
A.n(H2SO4)=2mol/L×0.1L=0.2mol,H2SO4和Na2CO3反应方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,根据方程式知,二者恰好反应生成强酸强碱溶液Na2SO4,溶液呈中性,根据电荷守恒判断c(Na+)、c(SO42-)相对大小;
B.CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,所以得CaO+H2O+Na2CO3=CaCO3↓+2NaOH,根据方程式知,二者恰好反应生成NaOH,反应后溶液中的溶质是NaOH;
C.加水稀释促进碳酸钠水解;
D.NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是硫酸钠,溶液呈中性.
解答 解:n(Na2CO3)=0.2mol,碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,
A.n(H2SO4)=2mol/L×0.1L=0.2mol,H2SO4和Na2CO3反应方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,根据方程式知,二者恰好反应生成强酸强碱溶液Na2SO4,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得(Na+)=2c(SO42-),故A错误;
B.CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,随着CO32-的消耗,CO32-+H2O?HCO3-+OH-向左移动,c(HCO3-)减小,反应生成OH-,则c(OH-)增大,导致溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$增大,故B正确;
C.加水稀释促进碳酸钠水解,则由水电离出的n(H+)、n(OH-)都增大,但氢离子、氢氧根离子物质的量增大倍数小于溶液体积增大倍数,c(H+)、c(OH-)减小,二者浓度之积减小,故C错误;
D.NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是硫酸钠,溶液呈中性,溶液由碱性变为中性,溶液的pH减小,因为硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;
故选B.
点评 本题为2015年高考题的改编题,考查离子浓度大小比较,为高频考点,明确盐类水解原理及物质之间的反应是解本题关键,结合电荷守恒、盐类水解特点分析解答,易错选项是C,注意C中计算的是水电离出的c(H+).c(OH-)之积而不是溶液中c(H+).c(OH-)之积,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸一般要保存棕色试剂瓶中,置于阴凉处,原因是:4HNO3$\frac{\underline{\;见光或受热\;}}{\;}$2NO2↑+O2↑+2H2O | |
| B. | 配制240ml浓度为1 mol•L-1的NaOH溶液,需将NaOH固体放在烧杯中,用托盘天平称取10.00g,选用250ml的容量瓶进行配制 | |
| C. | 常温下可用铁质或铝制容器储运浓硝酸,是因为常温下二者不发生反应 | |
| D. | 铵盐在加热时都会分解产生氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
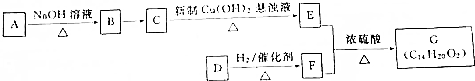
 或
或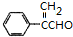 .
.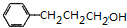 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$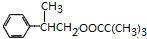 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+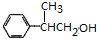 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$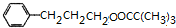 +H2O.
+H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com