
| A、H2SO4、Na2CO3、CaCl2 |
| B、HCl、NaOH、CuSO4 |
| C、H2CO3、CaO、Na2SO4 |
| D、HNO3、Ca(OH)2、NaOH |


科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、①③⑥ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
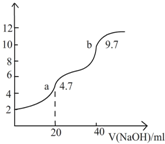 用0.1000mol/LNaOH溶液滴定20.00mlH2A溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图所示.下列有关说法错误的是( )
用0.1000mol/LNaOH溶液滴定20.00mlH2A溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图所示.下列有关说法错误的是( )| A、H2A的物质的量浓度为0.1000mol.L-1 |
| B、H2A是二元弱酸 |
| C、a-b段发生反应HA-+OH-=H2O+A2- |
| D、a点时HA-的水解程度大于电解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
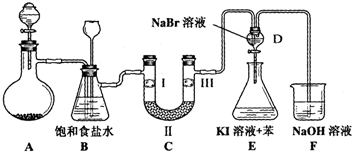
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com