
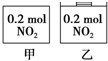
 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
分析 甲、乙存在平衡2NO2?N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大;但平衡移动的结果是降低NO2浓度增大,不会消除增大;反应混合气体的总质量不变,总的物质的量减小,混合气体的平衡摩尔质量增大,由此分析解答.
解答 解:甲、乙存在平衡2NO2?N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,
A.乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,但平衡移动的结果是降低NO2浓度增大,不会消除增大,故平衡时容器内c(NO2)的大小顺序为乙>甲,故A正确;
B.乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大,故平衡时N2O4的百分含量:乙>甲,故B正确;
C.甲、乙存在平衡2NO2?N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,所以平衡时甲中的压强与乙中的压强:甲<乙,故C错误;
D.乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,总的物质的量减小,乙中平均摩尔质量解得,故平衡时混合物的平均相对分子质量:乙>甲,故D错误;
故选AB.
点评 本题考查化学平衡的影响因素、化学平衡的有关计算等,难度中等,构建平衡建立的等效途径是解决问题的关键,注意等效思想的利用.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质中都只含C、H、O三种元素 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉、纤维素分子组成都可表示为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磺化、硝化、水化、风化、钝化等都是化学变化 | |
| B. | 干馏、常压分馏、减压分馏都是物理变化 | |
| C. | 甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com