
 ②Na2O2
②Na2O2 ③N2
③N2 ④H2O
④H2O .
. 分析 (1)质子数为8的原子为氧原子,利用质量数=质子数+中子数来分析;
(2)非金属强的元素在元素周期表中的右上方的位置;
(3)①氯化钾为离子化合物,钾离子与氯离子通过离子键结合;
②过氧化钠由2个钠离子和1个过氧根构成;
③氮气中存在3对共用电子对,氮原子最外层达到8个电子;
④水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
解答 解:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)非金属强的元素在元素周期表中的右上方的位置,在每个周期中第ⅦA族元素的非金属性最强,在第ⅦA族中F元素的非金属性最强,故答案为F;
(3)①KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ,故答案为:
,故答案为: ;
;
②Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故答案为:
,故答案为: ;
;
③氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故答案为:
,故答案为: ;
;
④水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查了电子式的书写方法,一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 对燃烧现象的深入研究 | B. | 对空气组成的研究 | ||
| C. | 用原子--分子论来研究化学反应后 | D. | 英国科学家汤姆生发现电子后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了保持腊肉肉质鲜美,添加过量的亚硝酸钠 | |
| B. | 为了防止食用鱿鱼变质,用甲醛水溶液浸泡存放 | |
| C. | 为了防止黄曲霉素对人体的危害,绝对不能食用霉变食物 | |
| D. | 为了防止摄入锌不足引起疾病,过量服用补锌药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
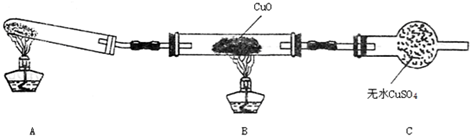
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
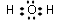 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
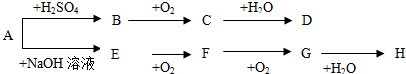
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com