
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
分析 A.铝合金质硬而轻且不易生锈;
B.合金比成分金属硬度大;
C.合金的熔点比成分金属的低;
D.铝的表面有一层致密的氧化物薄膜,抗腐蚀性能较强.
解答 解:A.铝合金质硬而轻且不易生锈,可做飞行器的材料,以减轻产品的质量,故A正确;
B.硬铝为铝的合金,强度跟铝相比有很大的提高,在某些性能上优于钢材,故B正确;
C.硬铝的熔点低于成分金属铝,故C错误;
D.铝属于活泼金属,铝与氧气反应其表面生成一层致密的氧化铝保护膜,使铝有很好的抗腐蚀性,常被建筑行业用作材料以及门窗框架,故D正确;
故选C.
点评 本题考查金属与合金在性能上的主要差异,题目难度不大,注意合金的熔点比其成分金属都低、硬度大.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
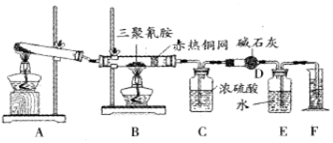
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其核磁共振氢谱中有2个信号(参见图1).
,其核磁共振氢谱中有2个信号(参见图1).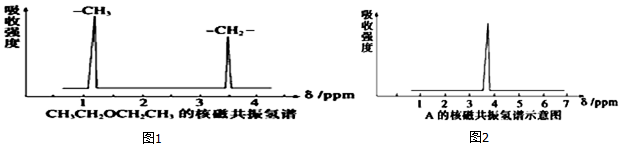
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
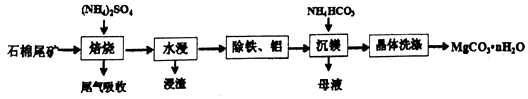
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com