
| A. | 标准状况下,3.36L氧气与2.4g碳反应,生成CO2分子数为0.2NA | |
| B. | 标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA | |
| C. | lL0.lmol•L-1氨水中NH3•H2O分子数为0.1NA | |
| D. | 10g46%酒精(C2H5OH)中含氧原子总数大于0.1NA |
分析 A.依据n=$\frac{V}{Vm}$=$\frac{m}{M}$计算氧气、碳的物质的量,结合C+O2$\frac{\underline{\;\;△\;\;}}{\;}$CO2解答;
B.氯气参加反应转移电子数与氯气表现性质有关;
C.一水合氨为弱电解质,部分电离;
D.水溶液中水中也含氧原子.
解答 解:A.标准状况下,3.36L氧气物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,与2.4g碳物质的量为$\frac{2.4g}{12g/mol}$=0.2mol反应,依据C+O2$\frac{\underline{\;\;△\;\;}}{\;}$CO2可知氧气不足,所以生成二氧化碳分子数小于0.2NA,故A错误;
B.氯气参加反应转移电子数与氯气表现性质有关,例如氯气与铁反应生成氯化铁,1mol氯气反应失去2mol电子,1mol氯气与氢氧化钠反应生成氯化钠、次氯酸钠,氯气既做氧化剂又做还原剂,反应转移1mol电子,故B错误;
C.一水合氨为弱电解质,部分电离,所以lL0.lmol•L-1氨水中NH3•H2O分子数小于0.1NA,故C错误;
D.溶剂水中含有氧原子,10g46%酒精水溶液含氧原子总数大于0.1NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙苯和邻二甲苯属于同分异构体 | |
| B. | 苯和苯乙烯属于同系物 | |
| C. | 糖类和蛋白质都属于天然高分子化合物 | |
| D. | 植物油和矿物油都属于油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
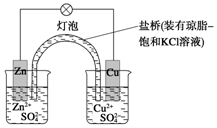 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
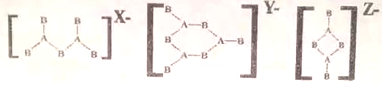
| A. | 4、4、2 | B. | 4、3、2 | C. | 3、3、2 | D. | 4、2、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )| A. | 若升高温度,X的体积分数增大,则正反应的△H>0 | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.001mol/(L•s) | |
| D. | 若图纵坐标是正反应速率,则反应应该在绝热条件下进行,图象最高点为平衡点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com