
分析 Ⅰ.CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量;
Ⅱ.原电池反应中负极是锌片,锌失电子发生氧化反应,原电池正极上是溶液中氢离子得到电子发生还原反应生成氢气,结合电子守恒计算,溶液浓度c=$\frac{n}{V}$;
解答 解:Ⅰ.CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量,则甲烷的燃烧热化学反应方程式为CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1 ;
Ⅱ.在铜片、锌片和400mL稀硫酸组成的原电池中,若电路中通过0.2mol电子,H2SO4恰好反应完毕,原电池电极反应为:
负极Zn-2e-=Zn2+,正极2H++2e-=H2↑,通过电子2mol,生成氢气1mol,消耗2molH+,消耗硫酸物质的量为1mol,
(1)若电路中通过0.2mol电子,生成气体的体积在标准状况下为:0.1mol×22.4L/mol=22.4L,
故答案为:2.24L;
(2)通过电子0.2mol,生成氢气0.1mol,消耗0.2molH+,消耗硫酸物质的量为0.1mol,原400mL稀硫酸的物质的量浓度=$\frac{0.1mol}{0.4L}$=0.25mol/L,
故答案为:0.25mol/L;
点评 本题考查了热化学方程式书写,原电池反应中的氧化还原反应电子转移定量计算,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 容器中SO2、O2、SO3共存 | B. | 容器中SO2 和SO3浓度相同 | ||
| C. | 容器中n(SO2):n(O2):n(SO3)=2:1:2 | D. | 容器中压强不随时间而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
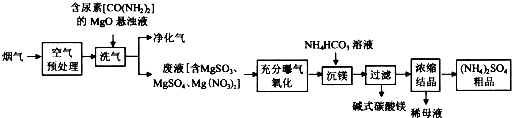
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
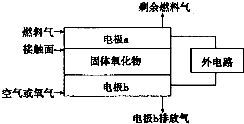 已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极a为电池负极 | |
| B. | VB2中V的化合价为+4价 | |
| C. | 电子由VB2极经KOH溶液流向a电极 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
 的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.
的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com