
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是元素原子核外电子排步周期性变化的必然结果 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
分析 A.元素的化学性质主要有价电子决定;
B.随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化;C.
C.K+、Mg2+、Al3+、H+的半径在减小,氧化性在增强,而I-、Br-、Cl-、F-的还原性在减弱;
D.由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它跟氢生成的氢化物的化学式为RH3,根据氢化物中含氢为8.82%,可以计算出R的相对原子质量.
解答 解:A.元素的化学性质主要有价电子决定,所以元素的化学性质随着核外电子排布而呈周期性变化,故A错误;
B.由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即元素原子核外电子排布周期性变化是引起元素性质周期性变化的决定因素,故B正确;
C.元素的非金属性越强,对应的阴离子的还原性越弱,I-、Br-、Cl-、F-还原性由强到弱,故C错误;
D.由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它的氢化物的化学式为RH3,设R的相对原子质量为x,则$\frac{3}{3+x}$×100%=8.82%,解得:x=31,故D错误.
故选B.
点评 本题考查原子结构及元素周期律,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,选项AD为解答的易错点,把握规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙可能由3种元素组成 | |
| B. | 若甲与乙中各元素质量比相同,则甲中一定含有氧元素 | |
| C. | 丙中一种元素原子的最外层电子数是内层电子总数的2倍,则丙一定是甲烷的同系物 | |
| D. | 若丁中为双原子分子,则丁中含有的化学键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
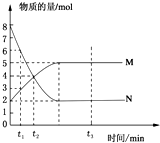 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
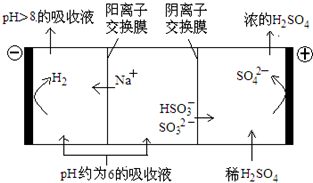
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 原理 |
| A | 用漂白精溶液对环境消毒 | 病毒蛋白质在漂白精溶液中发生盐析现象 |
| B | 用碳酸钠溶液浸泡水垢 | 水垢中溶解度较大的物质转化为溶解度较小的物质 |
| C | 含碘的食盐密闭保存于阴凉处 | 碘化钾不稳定易分解,从而损失碘元素 |
| D | 用纯碱溶液洗涤餐具表面油污 | 碳酸钠与油脂发生复分解反应生成可溶物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com