
| A. | 青蒿素由碳、氢、氧三种元素组成 | |
| B. | 青蒿素分子中碳、氢、氧的原子个数比为:15:22:5 | |
| C. | 青蒿素中碳、氢、氧三种元素的质量比为:90:11:40 | |
| D. | 青蒿素的相对分子质量为282g |
分析 A.根据物质的组成来分析;
B.根据物质的分子结构来分析;
C.根据化合物中元素质量比的计算方法来分析;
D.根据相对分子质量的单位来分析.
解答 解:A.青蒿素是由碳、氢、氧三种元素组成的,故A正确;
B.一个青蒿素分子由15个碳原子、22个氢原子和5个氧原子构成,故青蒿素分子中碳、氢、氧的原子个数比为:15:22:5,故B正确;
C.青蒿素中碳、氢、氧三种元素的质量比为(12×15):(1×22):(16×5)=90:11:40,故C正确;
D.相对分子质量单位是“1”,不是“克”,常常省略不写,故D错误;
故选D.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算等进行分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的过程 | |
| B. | 煤燃烧是化学能转化为热能的过程 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na 与足量H2O反应完全后可生成nA个H2分子 | |
| B. | 1 mol乙烯分子含有2nA碳碳双键 | |
| C. | 标况下,22.4LN2和H2混合气中含nA个原子 | |
| D. | 标况下,22.4LCl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2nA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | 0.1mol/L Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释0.1mol/L CH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向废水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
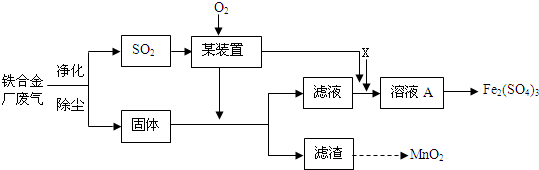
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com