
分析 乙遇水发生非氧化还原反应生成等物质的量的次碘酸和氯化氢,则乙为ICl,二元化合物甲,M=233.5,2.335g甲即0.01mol,加热至完全分解,生成0.01moL液体乙和224mL(标准状况下)黄绿色的单质丙气体即为Cl2,根据元素守恒可知,甲为ICl3,据此答题;
解答 解:乙遇水发生非氧化还原反应生成等物质的量的次碘酸和氯化氢,则乙为ICl,二元化合物甲,M=233.5,2.335g甲即0.01mol,加热至完全分解,生成0.01moL液体乙和224mL(标准状况下)黄绿色的单质丙气体即为Cl2,根据元素守恒可知,甲为ICl3,
(1)根据上面的分析可知,乙的化学式为ICl,
故答案为:ICl;
(2)甲为ICl3,甲在热水浴中分解的化学方程式为ICl3=ICl+Cl2↑,
故答案为:ICl3=ICl+Cl2↑;
(3)用KClO3、I2、浓盐酸在一定条件下制备甲,制备甲的离子反应方程式为ClO3-+I2+6H++5Cl-=2ICl3+3H2O,
故答案为:ClO3-+I2+6H++5Cl-=2ICl3+3H2O;
(4)甲为ICl3,
A.甲性质类似卤素单质,不能与可燃物、碱类一起储运,故A正确;
B.甲性质类似卤素单质,能与活泼金属反应,故B错误;
C.甲与硝酸酸化的硝酸银溶液作用能产生白色沉淀,故C错误;
D.甲性质类似卤素单质,一定条件下能与乙烯或苯反应,故D正确,
故选:AD;
(5)用海带制碘时,生成的粗碘中常混有ICl,ICl能与碘离子反应生成碘单质,所以提取碘时可以向粗碘中加入适量的KI固体加热升华可得碘单质,
故答案为:向粗碘中加入适量的KI固体加热升华可得碘单质.
点评 本题考查无机物的推断、氧化还原反应、实验方案设计,属于计算型推断,侧重考查学生分析计算能力、知识的迁移应用,题目难度中等.


科目:高中化学 来源: 题型:实验题
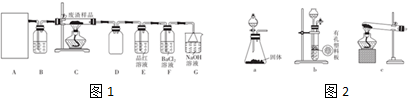
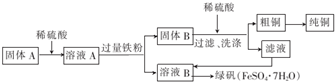
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
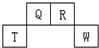 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | 原子半径Q>R>T | |
| B. | 原子序数比R多1的元素只能形成一种氢化物 | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 与W同一主族的下一周期元素不可作为半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器 | |
| B. | 石墨烯是从石墨材料中剥离出来、由碳原子构成的只有一层原子厚度的二维晶体,该晶体属于烯烃类物质 | |
| C. | 生物质能来源于植物及其加工产品所贮存的能量,其主要利用形式有:直接燃烧、生物化学转化、热化学转换等 | |
| D. | 使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
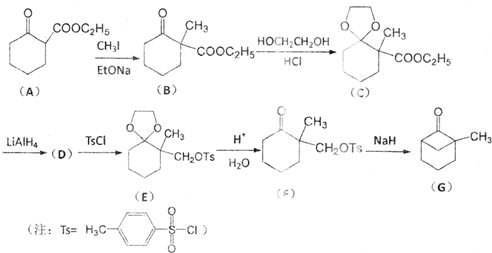
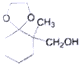 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(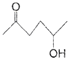 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH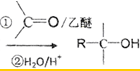
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含3.2amolHNO3的稀溶液中,加入2amol铁粉:5Fe+4NO3-+16H+═3Fe2++2Fe3++4NO↑+8H2O | |
| B. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 泡沫灭火器灭火时发生的反应:2Al3++3CO32-+H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 将AgCl白色沉淀加入Na2S溶液中反应:2AgCl+S2-═Ag2S↓+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
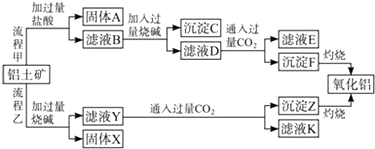
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com