
| 浓硫酸 |
| 170℃ |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
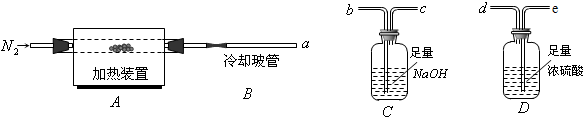
| A、瓶中盛有适量浓H2SO4,从A口进气来干燥NH3 |
| B、从B口进气,用排空气法收集CO2 |
| C、瓶中盛满水,从B口进气,用排水法收集NO2 |
| D、瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
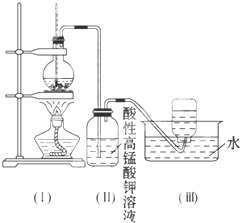
| A、实验装置保温、隔热效果差 |
| B、量取NaOH溶液的体积时仰视读数 |
| C、分多次把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D、用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
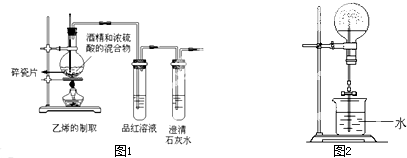
 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯:CH3CH2OH| 浓硫酸 |
| ℃170 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(气)+Br2(气)?2HBr(气) (正反应为放热反应) |
| B、N2(气)+3H2(气)?2NH3(气) (正反应为放热反应) |
| C、2SO3(气)?2SO2(气)+O2(气) (正反应为吸热反应) |
| D、4NH3(气)+5O2(气)?4NO(气)+6H2O(气) (正反应为放热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com