


 Fe3��(aq)��3OH��(aq) ��H��a kJ/mol
Fe3��(aq)��3OH��(aq) ��H��a kJ/mol H��(aq)��OH��(aq) ��H��b kJ/mol
H��(aq)��OH��(aq) ��H��b kJ/mol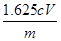 %��
%��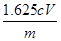 ��
��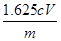 ��100% (2�֣������𰸼���)
��100% (2�֣������𰸼���) Fe(OH)3(aq) + 3H+(aq) ��H=��3b��a��kJ��mol-1 ��2�֣���ѧʽд��������ʽд��������ƽ��©д����״̬��©д��λ�����÷֣�
Fe(OH)3(aq) + 3H+(aq) ��H=��3b��a��kJ��mol-1 ��2�֣���ѧʽд��������ʽд��������ƽ��©д����״̬��©д��λ�����÷֣� ��0.01cVmol������Ȼ�����������0.01cVmol��162.5g/mol��1.625cVg������Ʒ���Ȼ�������������Ϊ
��0.01cVmol������Ȼ�����������0.01cVmol��162.5g/mol��1.625cVg������Ʒ���Ȼ�������������Ϊ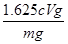 ��100%��
��100%��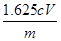 %��
%�� Fe3��(aq)��3OH��(aq) ��H��a kJ/mol����H2O(l)
Fe3��(aq)��3OH��(aq) ��H��a kJ/mol����H2O(l) H��(aq)��OH��(aq) ��H��b kJ/mol������ݸ�˹���ɿ�֪�ڡ�3���ټ��õ�����ʽ��Fe3+(aq)+3H2O(l)
H��(aq)��OH��(aq) ��H��b kJ/mol������ݸ�˹���ɿ�֪�ڡ�3���ټ��õ�����ʽ��Fe3+(aq)+3H2O(l) Fe(OH)3(aq) + 3H+(aq)�����Ը÷�Ӧ�ķ�Ӧ�ȡ�H=��3b��a��kJ��mol-1��
Fe(OH)3(aq) + 3H+(aq)�����Ը÷�Ӧ�ķ�Ӧ�ȡ�H=��3b��a��kJ��mol-1��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OCH3��H2O
CH3OCH3��H2O CH3OCH3(g)��CO2(g) ��H����247kJ/mol
CH3OCH3(g)��CO2(g) ��H����247kJ/mol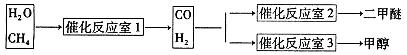
 CH3OCH3(g)��CO2(g)���ܱ������дﵽƽ���Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��
CH3OCH3(g)��CO2(g)���ܱ������дﵽƽ���Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��  CH3OH(g)��H2O (g) ��H��0��Ӧ�ﵽƽ��ʱ���ı��¶ȣ�T����ѹǿ��P������Ӧ�����CH3OH�����ʵ����������仯�����ͼ��ʾ�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ�ж���ȷ���� ������ţ�
CH3OH(g)��H2O (g) ��H��0��Ӧ�ﵽƽ��ʱ���ı��¶ȣ�T����ѹǿ��P������Ӧ�����CH3OH�����ʵ����������仯�����ͼ��ʾ�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ�ж���ȷ���� ������ţ�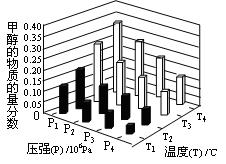
 CO(g)��3H2(g) ��H��0д��ƽ�ⳣ���ı���ʽ��
CO(g)��3H2(g) ��H��0д��ƽ�ⳣ���ı���ʽ�� 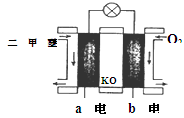
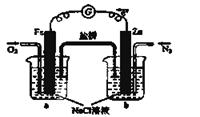
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g) + 3H2(g) ����H>0
CO2(g) + 3H2(g) ����H>0
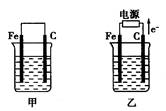
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2H2��+O2��
2H2��+O2�� 2H2��+O2��
2H2��+O2�� 2H2��+O2��
2H2��+O2�� CO+3H2
CO+3H2 CH3OH��g��+H2O��g������H="-49.0" kJ/mol,���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
CH3OH��g��+H2O��g������H="-49.0" kJ/mol,���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
 CH3OH��g����ƽ�ⳣ��:
CH3OH��g����ƽ�ⳣ��:| �¶�/�� | 0 | 100 | 200 | 300 | 400 |
| ƽ�ⳣ�� | 667 | 13 | 1.9��1 | 2.4��1 | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����69.4 kJ��mol��1�������� | B����45.2 kJ��mol��1 |
| C����69.4 kJ��mol��1 | D����45.2 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H2����H1 | B����H2+��H1 | C����H1����H2 | D������H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��4a��4b��4c | B��2a-2b+6c |
| C��2a��2b��2c | D��2a��6b��2c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
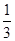 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
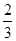 Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ��
Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ�� CH3OH(g)�������ͼʾ�ش���������:
CH3OH(g)�������ͼʾ�ش���������: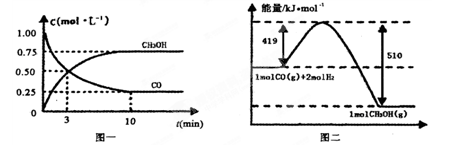
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 (Q1��Q2��Q3������0) |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ����
2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ���� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com