
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
分析 A、蔗糖与麦芽糖水解产物不相同;
B、甲苯分子中不存在单双键交替结构,苯环影响侧链,侧链易被氧化;
C、淀粉→葡萄糖→乙醇都是化学变化;
D、同系物的结构相似、相差n个CH2原子团,且官能团的种类与数目相同.
解答 解:A、蔗糖水解生成葡萄糖和果糖,麦芽糖水解生成葡萄糖,两者水解产物不同,故A错误;
B、苯环影响侧链,侧链易被氧化,则甲苯能使酸性高锰酸钾溶液褪色,不是甲苯中存在单双键交替的结构,故B错误;
C、用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故C正确;
D、甲醇中只有一个羟基、乙二醇(HOCH2CH2OH)中含有2个羟基,官能团个数不同,结构不相似,不是同系物,故D错误,
故选C.
点评 本题考查有机物的结构与性质,侧重考查及同系物、同分异构体的判断,注意把握醇的结构特点是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
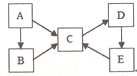 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
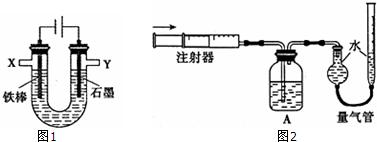
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
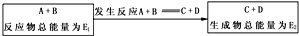
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

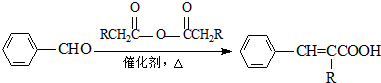
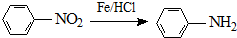
 ;
;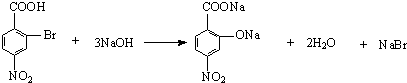 ;
;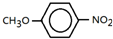 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
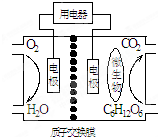
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com