
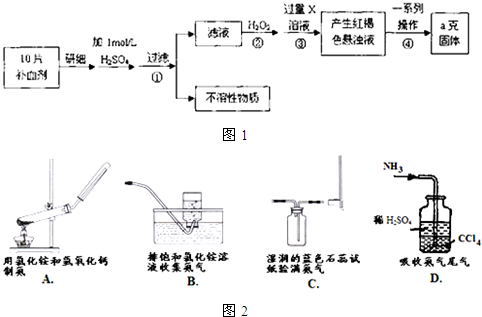
| ag |
| 160g/mol |
| 112a |
| 160 |
| 112a |
| 1600 |
| 112a |
| 1600 |


科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
- 4 |
查看答案和解析>>
科目:高中化学 来源:成都市2008届高中毕业班第三次诊断性检测理科综合能力测试化学卷 题型:058
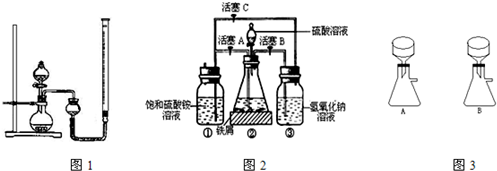
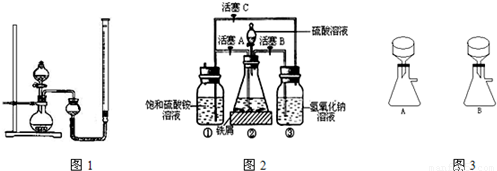
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为FeSO4·(NH4)2SO4·6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100 g水)如下表:

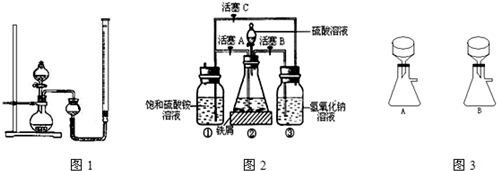
下图是模拟工业制备硫酸亚铁铵晶体的实验装置.

回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是________________.
(2)将处理好的铁屑放人锥形瓶中,加人稀硫酸.锥形瓶中发生反应的离子方程式可能为________________ (填序号).
A.Fe+2H+=Fe2++H2↑
B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞________,打开活塞________(填字母).容器③中NaOH溶液的作用是________________;向容器①中通入氢气的目的是________________.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是_____________;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是________、________、________________.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液.用0.5 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4-被还原成Mn2+时,耗KMnO4溶液体积20.00 mL.
滴定时,将KMnO4溶液装在________(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为________________;晶体中FeSO4的质量分数为________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
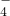 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
| -4 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市萧山中学高三(下)月考化学试卷(3月份)(解析版) 题型:填空题
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com