
| ||
| 0.112g |
| 56g/mol |
| 1mol×0.448L |
| 22.4L |
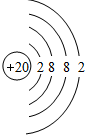 ;金属性Ca>Mg,所以其最高价氧化物对应水化物的碱性比Mg(OH)2强,故答案为:
;金属性Ca>Mg,所以其最高价氧化物对应水化物的碱性比Mg(OH)2强,故答案为: ; 强;
; 强; ,
, ;
;
| ||
| 0.112g |
| 56g/mol |
| 1mol×0.448L |
| 22.4L |


科目:高中化学 来源: 题型:
| A、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子还小 |
| C、石油裂化的主要是提高汽油的产量,石油裂解的主要是得到更多的乙烯 |
| D、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:填空题
(8分)有铁和铝的混合物共5.5g,完全溶解于200mL 36. 5%的浓盐酸(密度为1. 2 g/mL)中,在标准状况下共收集到4.48L H2,求:
(1)浓盐酸的物质的量浓度为 。
(2)铁的质量为 ,锌的质量为 。
(3)将反应后剩余的溶液,用水稀释至500mL,求稀释后溶液中盐酸的物质的量浓度(HCl挥发忽略不计) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列各组中的两种物质反应时,反应条件或反应物的量发生改变时,不会引起产物种类发生变化的是
A.Na和O2 B.Ca(OH)2和CO2
C.Al和NaOH D.AlCl3和NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.焰火中呈现的绚丽色彩,是各种金属元素焰色反应形成的
B.小苏打既是制作糕点的膨松剂,还是治疗胃酸过多的一种药剂
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰
D.我国是最早使用青铜合金的国家之一,目前世界上使用量最大的合金是钢
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高一上学期期中化学试卷(解析版) 题型:选择题
钠元素在自然界存在的主要形式为
A、金属钠 B、NaOH C、NaCl D、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com