
分析 (1)Ti是22号元素,原子核外电子数为22,根据能量最低原理书写价电子排布式;
(2)根据题目中提供的物理性质TiCl4在常温下是无色液体,熔点是-25℃,沸点136.4℃,来判断晶体类型;根据价层电子对互斥理论确定B原子的杂化类型;
(3)根据等电子体是指具有相同电子数目和原子数目的分子或离子来回答;
(4)根据配合物的结构分析,內界离子数为配位数,据此分析配体;
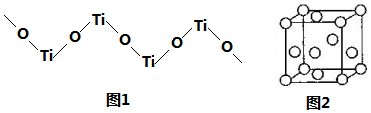
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比,Ti元素为+4价、O元素为-2价,据此书写其化学式;
(6)在每个钛的晶胞中含有钛原子数为8×$\frac{1}{8}$+$\frac{1}{2}$=4,设晶胞的连长为a,根据ρ=$\frac{m}{V}$计算得晶胞的体积,再计算得晶胞的边长.
解答 解:(1)Ti是22号元素,原子核外电子数为22,元素基态原子的电子排布式1s22s22p63s23p63d24S2,则价电子排布式为:3d24S2,
故答案为:3d24S2;
(2)因TiCl4在常温下是无色液体,熔点是-25℃,沸点136.4℃,熔沸点低,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,BH4-中B原子价层电子数=4+$\frac{1}{2}$(3+1-4×1)=4,且不含孤电子对,B原子是sp3杂化,BH4-是正四面体构型,
故答案为:分子;sp3;
(3)CNO-中电子数为:6+7+8+1=22,与CO2具有相同电子数目和原子数目,是等电子体,常见粒子还有N2O、CS2、BeCl2等;
故答案为:CO2(或N2O、CS2、BeCl2等);
(4)[Ti( H2O)6]Cl3(紫色),配体为:H2O,配位数为6,[TiCl(H2O)5]Cl2•H2O(绿色),配体为Cl-、H2O,配位数为6,两者配位数相同,
故答案为:相同;Cl-、H2O;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;
Ti元素为+4价、O元素为-2价,据此书写其化学式为[TiO]n2n+,
故答案为:[TiO]n2n+;
(6)在每个钛的晶胞中含有钛原子数为8×$\frac{1}{8}$+$\frac{1}{2}$=4,设晶胞的连长为a,根据ρ=$\frac{m}{V}$=$\frac{4×48}{\frac{{N}_{A}}{{a}^{3}}}$所以a=$\root{3}{\frac{4×48}{ρ{N}_{A}}}$=$\root{3}{\frac{192}{{N}_{A}ρ}}$,
故答案为:$\root{3}{\frac{192}{{N}_{A}ρ}}$.
点评 本题考查物质结构和性质,涉及核外电子排布、等电子体、杂化方式的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,题目难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2与O2反应生成NO | B. | 由NH3转变成 NH4HCO3 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 豆科植物的根瘤吸收氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2H2(g)+O2(g)═2H2O(l) 在室温下可自发进行,则该反应的△H<0 | |
| B. | 常温常压下,7.8gNa2O2与水完全反应,产生1.12L气体 | |
| C. | 煤的干馏是物理变化,石油的裂化是化学变化 | |
| D. | 气体分子总数不再改变时,反应H2(g)+I2(g)?2HI(g))达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物是大气污染物之一 | |
| B. | X、Y、Z的离子半径逐渐增大 | |
| C. | X的最高价氧化物的水化物能分别与Y、Z的最高价氧化物对应水化物反应 | |
| D. | 最简单氢化物的热稳定性:Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O含有的中子数为8NA | |
| B. | 25℃时,l L pH=2的H2SO3溶液中所含H+数为0.01 NA | |
| C. | 标准状况下,22.4 L CH3OH中含有的共价键数为5 NA | |
| D. | 0.1 mol Cl2溶于水,转移电子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与足量稀硝酸的反应 | B. | 碳酸氢钠与足量盐酸的反应 | ||
| C. | 碳酸钡与少量稀盐酸的反应 | D. | 碳酸钠与足量稀醋酸的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com