
(5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |

| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
(5分)
(1)A (1分)
(2)高温下乙酸乙酯挥发 (1分)
(3) 乙酸乙酯在水溶液中形成乳浊液 (1分)
(4)有机层和水层接触面太小(1分)
(5)乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。(1分)
解析试题分析:(1)实验1中的乙酸乙酯不水解,所以下层仍是橙色,上层为无色的乙酸乙酯;实验2中加入稀硫酸,乙酸乙酯水解后的溶液呈酸性,酸使甲基橙变红色,所以下层是红色,上层是无色;实验3加入氢氧化钠,乙酸乙酯水解后的溶液呈碱性,所以碱遇石蕊变蓝色,下层是蓝色,上层是无色,答案选A。
(2)乙酸乙酯的沸点较低,温度过高,造成乙酸乙酯的挥发损失;
(3)乙酸乙酯微溶于水,振荡后形成乳浊液使溶液显浑浊;
(4)乙酸乙酯微溶于水,所以有机层和水层接触面太小,反应速率慢;
(5)改进的实验与原来相比,差别在于加入了饱和食盐水,说明乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。
考点:考查乙酸乙酯的水解实验的探究,实验条件的分析


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8 000 mg/L~10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是_____性和_____性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是_____。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一根光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是__________。
(5)基于假设②,结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
A B C D E
(1)实验室制备Cl2依据的原理是(化学方程式): ,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液与Cl2反应的离子方程式: 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
( 14分)某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
(1)Na2O2中含有的化学键类型: ;请写出a中反应的化学方程式 。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O =" NaOH" + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中, ,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
① ;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |  |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… | ② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
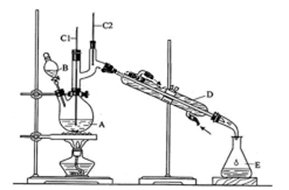
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 。 | ,则证明生成 物中含Na2SO4。 |
| 步骤3:往Ⅱ试管中 。 | 若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图中的实验装置可以用于实验室制取乙炔。请填空:
(1) 图中A管的作用是 ,
制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到
现象,若通入溴水中,发生 反应。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与生活、生产、社会密切相关。下列说法正确的是( )
| A.高纯度的单晶硅用于制造登月车的光电池和光导纤维 |
| B.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| C.加碘食盐能使淀粉溶液变蓝 |
| D.有些肾病患者要定期进行血透,血透原理是利用渗析的方法净化血液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”。化学已渗透到人类生活的各个方面。下列说法正确的是
| A.PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响 |
| B.绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物 |
| C.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| D.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com