
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。
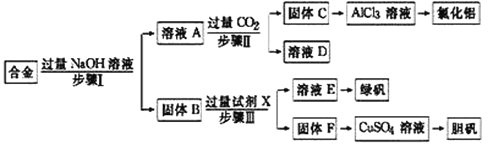
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_______________。实验室中进行该操作时,用到的玻璃仪器有烧杯、______________________。
(2)溶液A中的阴离子主要有__________________;由合金生成A溶液的离子方程式为:_______________。试剂X是________________。
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为_________________。
(4)从环境保护角度考虑,采用固体F加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,其化学方程式是_______________________________。
【答案】过滤 玻璃棒、漏斗 AlO2-、OH- 2Al+2OH-+2H2O=2AlO2-+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 稀硫酸 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
【解析】
合金溶于过量的氢氧化钠溶液中生成偏铝酸钠,铁和铜不溶。偏铝酸钠溶液中通入过量的二氧化碳生成氢氧化铝沉淀,氢氧化铝溶解在盐酸中生成氯化铝,最终得到氯化铝晶体;铁和铜的混合物中加入稀硫酸生成硫酸亚铁,最终可以得到绿矾晶体。由于铜不溶,可以加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,据此判断。
(1)步骤Ⅰ、Ⅱ、Ⅲ中均分离产生固体,所以需进行的实验操作是过滤。实验室中进行该操作时,用到的玻璃仪器有烧杯、玻璃棒、漏斗。
(2)溶液A中的阴离子主要有铝与氢氧化钠生成的AlO2-和剩余氢氧化钠的OH-;合金溶于过量的氢氧化钠溶液中生成偏铝酸钠和氢气,铁和铜不溶,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;由于要制备绿矾,则试剂X是能够溶解铁的稀硫酸。
(3)向溶液A中通入过量CO2气体生成固体C氢氧化铝的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)从环境保护角度考虑,用固体F制备CuSO4溶液的方法不是用铜与浓硫酸反应转化为硫酸铜,而是在加热条件下铜被氧气氧化为氧化铜,再被稀硫酸溶解生成硫酸铜,反应的化学方程式为2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。
2CuSO4+2H2O。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 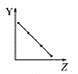 b.
b. 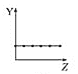 c.
c. 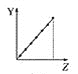 d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于______________(填字母)。
a.金属材料b.无机非金属材料c.有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是_______________(填字母)。
a.陶瓷b.水泥c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是_______________(填字母)。
a.5、4b.6、3c.7、2
④下列物品的构成材料中主要是合成高分子材料的是_______________(填字母)。
a.宣纸b.羊毛衫c.保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是________________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
⑵良好的生态环境可以提升生活质量。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是________________。
a.CO和NOx反应的化学方程式为:2xCO + 2NOx=2xCO2 + N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出来的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_______________(填字母)。
a.NO、NO2b.甲醛、苯c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_______________(填字母)除去其中含有的油类、氰化物。
a.中和法b.沉淀法c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸附悬浮颗粒物,写出铝离子与水反应的离子方程式___________________________。
⑶均衡营养、合理用药是保证人体健康的重要途径。
①葡萄糖可作为营养剂供给人体能量,其在人体内发生的主要反应是_______________(填字母)。
a.加成反应
②维生素C能防治坏血病,可通过食用富含它的食物进行补充,碱性条件下维生素C易被空气氧化,为减少维生素C的损失,烹调食物时可加入少许 _______________(填字母)。
a.白糖b.食醋c.苏打
③人体内有8种氨基酸必须通过食物摄入,某品牌蛋糕中含有下列物质,其中水解生成氨基酸的是 _______________(填字母)。
a.纤维素b.蛋白质c.油脂
④“胃舒平”又名复方氢氧化铝,除主要成分氢氧化铝外,还含有一定量的三硅酸镁(2MgO·3SiO2·nH2O),三硅酸镁与胃酸发生反应生成MgCl2和H2SiO3,其反应方程式是______________。
B.《有机化学基础》
⑴根据分子中所含官能团可预测有机化合物的性质。
①分子中所有碳原子位于同一条直线上的是________________(填字母)。
a.丙烷b.丙烯c.丙炔
②能发生加成反应的有机物是______________(填字母)。
a.CH3CH2Brb.CH3CH2OHc.葡萄糖
③能鉴别乙烯与乙烷的试剂是______________(填字母)。
a.水b.酸性KMnO4溶液c.NaOH溶液
④下列化合物中,能发生酯化反应的是_______________。(填字母)
a.CH3CHOb.HCOOCH3c.CH3COOH
⑤与![]() 和
和![]() 都能反应的是______________。(填字母)
都能反应的是______________。(填字母)
a.FeCl3溶液b.金属钠c.饱和Na2CO3溶液
⑵非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
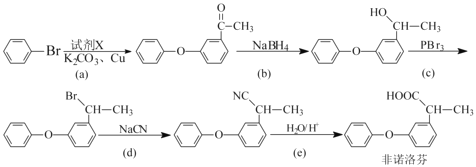
①反应中加入的试剂X的分子式为C8H8O2,X的结构简式为 ________________。
②上述反应中是取代反应的有 ________________(填字母),是还原反应的有 _______________(填字母)。
③非诺洛芬的一种同分异构体满足下列条件,写出该异构体的结构简式: ________________。
Ⅰ不能与FeCl3发生显色反应,但其一种水解产物能与FeCl3发生显色反应。
Ⅱ分子中有3种不同化学环境的氢,且分子中含有两个苯环。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
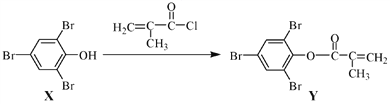
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素W、X、Y、Z在元素周期表中的位置如图所示,这四种元素的最外层电子数之和为24,下列判断正确的是
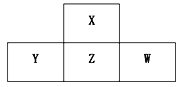
A.X、Z、W的原子半径依次增大
B.ZX2能使酸性高锰酸钾溶液褪色
C.Z元素的气态氢化物的沸点比X的高
D.W元素的氧化物的水化物酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的充放电总反应为:PbO2 + 2H2SO4 + Pb![]() 2 PbSO4 + 2H2O 下列说法正确的是
2 PbSO4 + 2H2O 下列说法正确的是
A.在放电时,该电池正极上的金属铅被还原
B.在放电时,负极发生的反应是 Pb + SO42--2e-=PbSO4
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4 + 2e-=Pb + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2L的恒容密闭容器中发生反应:CO(g) + Cl2(g) ![]() COCl2(g)其中容器Ⅰ中5 min时到达平衡。
COCl2(g)其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 4.0 | 4.0 | 0 | 3.2 |
Ⅱ | 500 | 4.0 | a | 0 | 2.0 |
Ⅲ | 600 | 2.0 | 2.0 | 2.0 | 2.8 |
下列说法不正确的是
A.a = 2.2 mol
B.容器Ⅲ中前5 min的平均反应速率v(CO) = 0.08 mol·L-1·min-1
C.该反应在500℃时的平衡常数K = 5
D.若容器Ⅰ起始投料为CO 2.0 mol、Cl2 2.0 mol,平衡时CO转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下述四个实验均能发生化学反应:

下列判断不正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+只显还原性
C.实验③中发生的是置换反应
D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D具有酸性和强氧化性,是一种高效广谱杀菌剂,其制备路线如下:
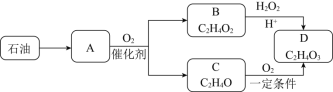
已知:A在标况下的密度为1.25gL-1,B具有酸性,C能发生银镜反应。请回答:
(1)A的结构简式______。
(2)C→D的反应类型______。
(3)B→D的化学方程式______。
(4)下列说法不正确的是______。
A.由石油得到A的方法称为裂化
B.若A在一定条件下能与B发生加成反应,则其产物可能为乙酸乙酯
C.有机物D能杀菌消毒的主要原因是含有-COOH结构
D.C能使高锰酸钾酸性溶液和溴水褪色,其原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com