
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:实验题
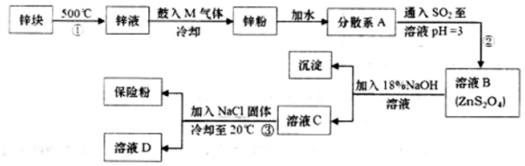
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+2H2(g)=CH3OH(g) | |
| B. | CaCO3(g)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g) | |
| C. | C(s)+O2(g)=CO2(g) | |
| D. | 2Hg(l)+O2(g)=2HgO(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | HgS | Ag2S | MnS | CuS |
| 溶度积常数 | 6.4×10-53 | 6.3×10-50 | 2.5×10-13 | 1.3×10-36 |
| A. | HgS | B. | Ag2S | C. | MnS | D. | CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
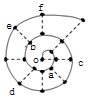 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
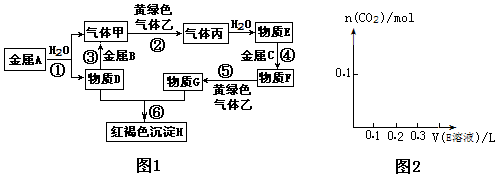
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com