
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
分析 A.纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;
B.从物质的性质和发生的反应判断,煤的干馏是在隔绝空气下加强热发生分解反应,是一种复杂的物理、化学变化,而石油的分馏是根据物质的沸点不用进行分离的,属于物理变化;
C.根据煤的干馏产物来分析;
D.根据煤的气化得到水煤气.
解答 解:A.裂解汽油主要成分为C6~C9烃类,有时也包含C5烃以及C9以上重质烃类,故A错误;
B.煤的干馏是在隔绝空气下加强热发生分解反应,是一种复杂的物理、化学变化,而石油的分馏是根据物质的沸点不用进行分离的,属于物理变化,故B错误;
C.煤干馏可以得到焦炭、焦炉气、煤焦油(甲烷、苯和氨)等重要化工原料,故C正确;
D.煤的气化得到水煤气,故D错误.
故选C.
点评 本题考查化石燃料的使用,涉及到煤和石油的综合利用等知识,难度不大,注意积累基础知识.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
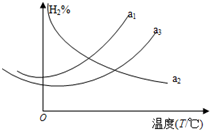 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:| 反应时间t/min | 20 | 40 | 60 | 80 |
| c(CO2)(mol/L) | 0.300 | 0.180 | 0.109 | 0.066 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>A>B>D | B. | 价电子数D>C>A>B | ||
| C. | 离子半径C3+>D->B+>A2+ | D. | 单质的还原性A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
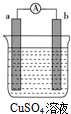 某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
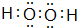 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
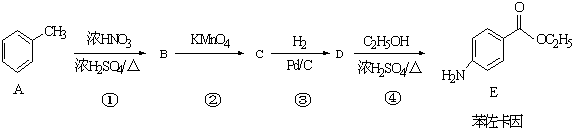
 .
.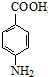 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$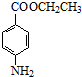 +H2O
+H2O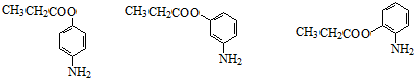 (其中一种)(任写一种)
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
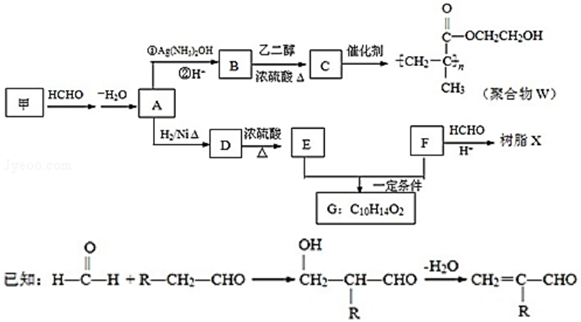
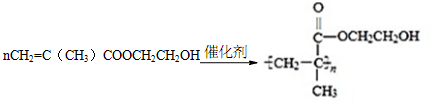 .
.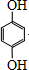
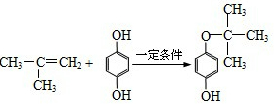 ,反应类型是加成反应.
,反应类型是加成反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com