
 已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
分析 (1)根据第一至第四电离能的变化可判断出各元素的最高化合价,进而推断元素的种类,周期表中,同周期元素从左到右电负性逐渐增强;
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输,W为铁元素,根据能量最低原理及洪特规则书写电子排布式;从N2的结构分析lCN+中π键数目,W(CN)2沉淀为Fe(CN)2,与过量KCN反应,由配离子结构示意图可知生成K4[Fe(CN)6].
解答 解:(1)从表中原子的第一至第四电离能可以看出,X的第一电离能较小,而第二电离子能较大,说明易失去1个电子,则X的化合价为+1价,应为Na元素,Y的第一、第二电离能较小,可失去2个电子,即最外层应有2个电子,应为Mg元素,而Z的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,应为Al元素,周期表中,同周期元素从左到右电负性逐渐增强,则X、Y、Z的电负性从大到小的顺序为Al、Mg、Na,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al,
故答案为:Al、Mg、Na;因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
(2)①W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输,W为铁元素,Fe是26号元素,铁元素基态原子电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2,
故答案为:3d64s2;
②将C原子及1个电子用“N”代换可得CN-等电子体分子N2,N2中,N原子之间含有2个π键,已知CN-与N2结构相似,则1molCN-中π键数目为2NA,
故答案为:N2;2NA;
③由配离子结构示意图可知黄血盐的化学式为K4[Fe(CN)6],则反应的化学方程式为Fe(CN)2+4KCN=K4[Fe(CN)6],
故答案为:Fe(CN)2+4KCN=K4[Fe(CN)6].
点评 本题考查原子、分子以及晶体的结构和性质,题目难度中等,本题注意把握电子排布式的书写、晶体类型的判断以及晶体结构的分析等方法性问题的总结和积累.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Y两元素能形成阴阳离子个数比都是1:2的化合物Y2X、Y2X2 | |
| B. | Z的简单离子在同周期元素所形成的简单离子中半径最小,Z的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应 | |
| C. | Y、Z所在周期的所有元素中Y的金属性最强,工业上通过电解其熔融氯化物得到Y单质 | |
| D. | X元素形成的单质存在同素异形现象,其中以X2单质最为常见且氧化性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的物质的量浓度为0.1mol/L | B. | Na+ 的物质的量浓度为1mol/L | ||
| C. | 含4g氢氧化钠 | D. | 含0.1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有④ | C. | ①和④ | D. | ①和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝粉和MnO2制得锰 | |
| B. | 用电解熔融氯化铝的方法制得单质铝 | |
| C. | 氯化铝溶液和过量氢氧化钠溶液反应制备Al(OH)3 | |
| D. | 用镁粉和空气反应制备Mg3N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
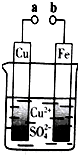
| A. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| B. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| C. | a和b不连接时,铁片上会有金属铜析出 | |
| D. | a和b用导线连接时,外电路中每通过0.1mol电子,铜的质量理论上增加3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| B. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| C. | 各能层含有的能级数为n-1 (n代表能层序数) | |
| D. | 各能层含有的电子数为2n2(n代表能层序数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com