
下列说法中正确的是 ( )
A. 熵增加且吸热的反应一定是自发反应 B. 熵增加且放热的反应一定是自发反应
C. 熵减少且放热的反应一定是自发反应 D. 熵减少且吸热的反应一定是自发反应
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、Fel2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br一一定被氧化
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgN03溶液,只产生白色沉淀,说明原溶液中的I一、Fe2+、Br一均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_____ _____;
(2)写出与H2O分子互为等电子体的微粒__ ________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
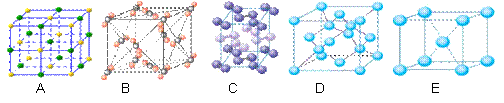 |
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.含有大量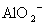 的溶液中:K+、
的溶液中:K+、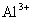 、
、 、
、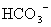 可共存
可共存
B.CO(g)的燃烧热是283.0kJ· ,则
,则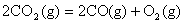 反应的
反应的
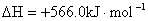
C.用NaOH溶液雕刻工艺玻璃上的纹饰
D.在某钠盐溶液中含有等物质的量的 、
、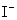 、
、 、
、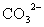 、
、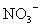 、
、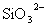 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有
中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有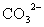
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应原理可以用于检查司机是否酒后开车。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反应中,氧化剂是 。如果在反应中生成1molCr3+,转移电子数为 。(用NA表示阿伏加德罗常数)
(2)写出上述化学方程式所缺项(填化学式) 。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸点分别是78.5℃、34.5℃,分离二者混合物的方法是 ,乙醇比乙醚的沸点高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定的条件下,将10molH2和1molN2充入一密闭容器中,在适当条件下使其发生反应:N2+3H2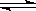 2NH3,达到平衡后。则H2的转化率可能是( )
2NH3,达到平衡后。则H2的转化率可能是( )
A.35% B.30% C.25% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.0.5molO3,与11.2 LO2所含的分子数一定相等
B. 25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H)相等
D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+wO2(g) = 4SO3 (g)的△H相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X2、Y2、Z2、W2四种物质的氧化能力强弱顺序为:W2>Z2>X2>Y2,判断下列氧化还原反应,能够发生的是( )
A.2W-+Z2===2Z-+W2 B.2X-+Y2===2Y-+X2
C.2Y-+W2===2W-+Y2 D.2Z-+X2===2X-+Z2
查看答案和解析>>
科目:高中化学 来源: 题型:
)镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝合金废料转化为硫酸铝晶体实验流程如下:
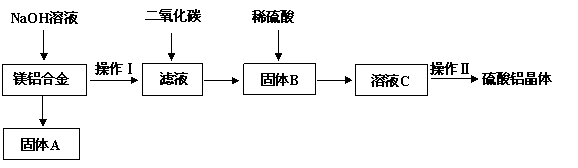
试回答下列问题:
(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式 ▲ ,固体B的化学式 ▲ 。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 ▲ 、 ▲ 、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 ▲ 。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。计算得硫酸铝晶体的化学式为 ▲ 。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知: 。
。
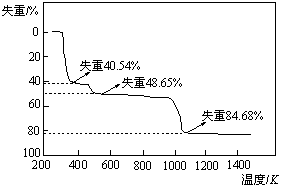 根据图示数据计算确定每步分解的产物,写
根据图示数据计算确定每步分解的产物,写
出第一阶段分解产物的化学式 ▲ ,第三阶段反应化学方程式 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com