
分析 (1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,根据氢离子和氢氧根离子浓度相对大小确定溶液的酸碱性;
(2)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大;
B、根据溶液中电荷守恒判断;
C、根据题意知NaHA溶液呈酸性,Na2A溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量;
D、根据题意知NaHA溶液呈酸性,Na2B溶液呈碱性,则向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于KOH的体积,据此确定钠离子和钾离子浓度之和;
(3)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
(4)0.1mol•L-1H2B溶液,H2B═H++HB-,电离出0.1mol/LH+,0.1mol•L-1NaHB溶液的pH=2,则由HB-?H++B2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HB-电离;
(5)NaHB溶液显酸性,存在HB-?H++B2-,则c(Na+)>c(HB-)>c(H+)>c(OH-),结合水的电离分析.
解答 解:(1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性;
故答案为:酸性;H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解;
(2)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故A错误;
B、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故B正确;
C、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;
D、NaHA溶液呈酸性,Na2A溶液呈碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;
故答案为:BC;
(3)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,故答案为:增大;
②加盐酸发生反应:B2-+H+?HB-,B2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大,
故答案为:增大;加盐酸发生反应:B2-+H+?HB-,B2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大.
(4)0.1mol•L-1H2B溶液,H2B═H++HB-,电离出0.1mol/LH+,0.1mol•L-1NaHB溶液的pH=2,则由HB-?H++B2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HB-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;0.1 mol/LNaHB溶液的pH=2,说明其中c(H+)=0.01 mol/L,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol/L H2B溶液中c(H+)<0.11 mol/L
(5)NaHB溶液显酸性,存在HB-?H++B2-,则c(Na+)>c(HB-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分B2-发生水解,使c(B2-)减小,所以c(H+)>c(B2-),即NaHB溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),
故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
点评 本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系、外界条件对化学平衡的影响等知识点,题目难度中等,根据温度、电解质溶液对难溶物性质的影响和电荷守恒、物料守恒来分析解答即可.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
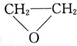
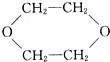
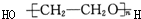
| A. | 只有① | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
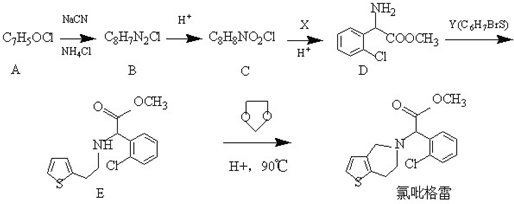
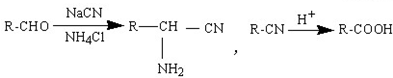
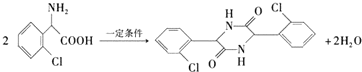 .
.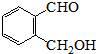 为有机原料制备化合物的合成路线流程图
为有机原料制备化合物的合成路线流程图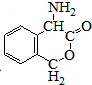 (无机试剂任选).合成路线流程图示例如下:
(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
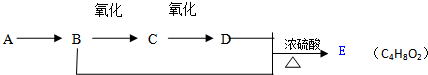
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应是放热反应 | |
| B. | 要加热或高温才能进行的化学反应一定是吸热反应 | |
| C. | 物质发生化学反应一定要有新物质生成但不一定要伴随着能量变化 | |
| D. | 旧的化学键断裂会释放出能量,而要生成新化学键要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 质子数相同的微粒,它们的化学性质基本相同 | |
| C. | 苯和溴苯的混合物可用分液法分离 | |
| D. | 由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
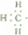 .
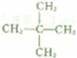
. .
.
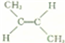
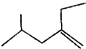 的系统命名4-甲基-2-乙基-1-戊烯.
的系统命名4-甲基-2-乙基-1-戊烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com