
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①Cl2中Cl-Cl原子之间只存在非极性键,为单质;
②Na2O2中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物;
③NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物;
④HCl分子中H-Cl原子之间只存在极性键,为共价化合物;
⑤H2O2中H-O之间存在极性键、O-O原子之间存在非极性键,为共价化合物;
⑥MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
⑦NH4Cl中铵根离子和氯离子之间存在离子键、N-H原子之间存在极性共价键,为离子化合物;
(1)通过以上分析知,只含离子键的是⑥,故选⑥;
(2)只有极性键构成的物质是④,故选④;
(3)只有非极性键构成的物质是①,故选①;
(4)只有非金属元素组成的离子化合物是⑦,故选⑦;
(5)由极性键和非极性键构成的物质是⑤,故选⑤;
(6)由离子键和极性键构成的物质是③⑦,故选③⑦;
(7)由离子键和非极性键构成的物质是②,故选②;
(8)属于离子化合物的是②③⑥⑦,故选②③⑥⑦;
(9)属于共价化合物的是④⑤,故选④⑤.
点评 本题考查化合物和化学键的判断,为高频考点,侧重考查学生分析判断能力,明确物质构成微粒及微粒之间作用力是解本题关键,注意不能根据是否含有金属元素判断离子键,为易错点.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
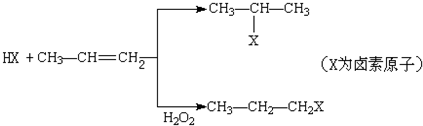
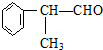 的物质,该物质是一种香料.
的物质,该物质是一种香料.
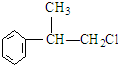 ,
,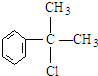 .
.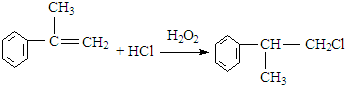 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):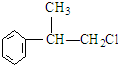 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl. 的水解产物
的水解产物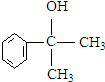 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低.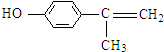 ,
,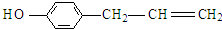 ,
,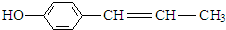 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com