
下列各图所表示的反应属于吸热反应的是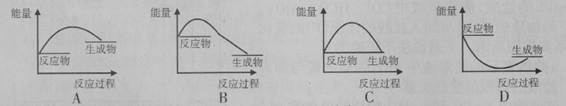
科目:高中化学 来源: 题型:单选题
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
| A.天然气、石油、流水、风力、氢气为一级能源 |
| B.无论是风力发电还是火力发电,都是将化学能转化为电能 |
| C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
| D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生反应 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g) ===2H2O(g) ΔH=-Q2 ②
H2O(g) ===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为 ( )
| A.4Q1+0.5Q2+9Q3 | B.4Q1+0.5Q2 | C.4Q1+Q2+10Q3 | D.4Q1+2Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.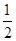 N2H4(g)+ N2H4(g)+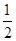 O2(g)=== O2(g)===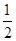 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知H—H键能为436 kJ·mol-1,N—H键能为391 kJ·mol-1,根据化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
| A.431 kJ·mol-1 | B.946 kJ·mol-1 |
| C.649 kJ·mol-1 | D.896 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
| A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
| B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1 SO2(g) △H<-Q kJ·mol-1 |
| D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2011年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路——“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气;②煤;③石油;④水能;⑤太阳能;⑥地热能;⑦风能;⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com