
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

 .
.分析 在浓硫酸作催化剂、加热条件下,甲醇和苯甲酸发生酯化反应生成苯甲酸甲酯,冷却后向烧瓶中加入水,将得到的混合溶液移置到分液漏斗中,然后进行分液,将得到的上层液体倒入锥形瓶中,锥形瓶中加入饱和的碳酸钠溶液,饱和的碳酸钠溶液能抑制苯甲酸甲酯的溶解,能和苯甲酸、硫酸反应生成钠盐,然后过滤,最后蒸馏得到粗产品;
(1)混合溶液时,先加入密度小的液体,后加入密度大的液体,且甲醇都易挥发;
二者在浓硫酸作催化剂、加热条件下发生酯化反应生成苯甲酸甲酯;
(2)该反应是可逆反应,反应物CH3OH过量,促进平衡正向移动;
(3)分液时上层液体从上口倒出,温度计的温度应该大于苯甲酸甲酯的熔点而小于苯甲酸的熔点;
(4)Na2CO3溶液能消耗硫酸和苯甲酸,降低酯的溶解度;
(5)苯甲酸甲酯的产率=$\frac{实际质量}{理论质量}×100%$.
解答 解:在浓硫酸作催化剂、加热条件下,甲醇和苯甲酸发生酯化反应生成苯甲酸甲酯,冷却后向烧瓶中加入水,将得到的混合溶液移置到分液漏斗中,然后进行分液,将得到的上层液体倒入锥形瓶中,锥形瓶中加入饱和的碳酸钠溶液,饱和的碳酸钠溶液能抑制苯甲酸甲酯的溶解,能和苯甲酸、硫酸反应生成钠盐,然后过滤,最后蒸馏得到粗产品;
(1)混合溶液时,先加入密度小的液体,后加入密度大的液体,苯甲酸、甲醇混合时放出大量热量,甲醇易挥发,所以应该最后加入浓硫酸;
二者在浓硫酸作催化剂、加热条件下发生酯化反应生成苯甲酸甲酯,反应方程式为 ,
,
故答案为:浓硫酸密度较大,且易于苯甲酸、甲醇混合放出大量热量,甲醇易挥发; ;
;
(2)该反应是可逆反应,反应物CH3OH过量,促进平衡正向移动,从而提高苯甲酸的转化率,
故答案为:该反应是可逆反应,增加甲醇的量,使平衡向右移动,有利于提高苯甲酸的转化率;
(3)分液时上层液体从分液漏斗的上口倒出,温度计的温度应该大于苯甲酸甲酯的熔点而小于苯甲酸的熔点,所以温度控制在199.6℃左右,故答案为:分液漏斗的上口;199.6℃左右;
(4)Na2CO3溶液能消耗硫酸和苯甲酸,降低酯的溶解度,
故答案为:通过反应消耗硫酸、苯甲酸,降低苯甲酸甲酯的溶解度;
(5)苯甲酸的物质的量=$\frac{12.2g}{122g/mol}$=0.1mol,甲醇的物质的量=$\frac{0.79g/mL×20mL}{32g/mol}$=0.5mol,根据方程式知,甲醇过量,应该以苯甲酸为标准进行计算,n(苯甲酸甲酯)=n(苯甲酸)=0.1mol,则苯甲酸甲酯的质量=0.1mol×136g/mol=13.6g,苯甲酸甲酯的产率=$\frac{实际质量}{理论质量}×100%$=$\frac{8.84g}{13.6g}×100%$=65%,
故答案为:65%.
点评 本题考查物质制备,为高频考点,涉及实验基本操作、基本计算、反应条件的判断、物质分离和提纯等知识点,明确实验原理及物质性质、物质分离提纯方法是解本题关键,注意冷凝管中水流方向,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 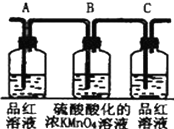 |  |  |  |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
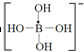 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 具体内容 |
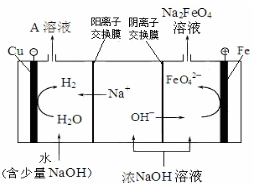
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
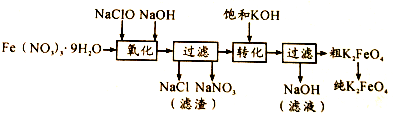
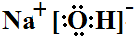 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
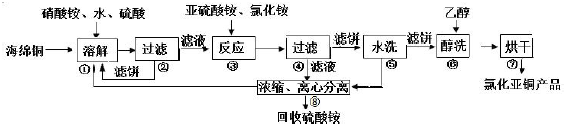
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com