
| A£®Ķ¬ÅØ¶ČµÄNa2SO4ŗĶNa2CO3»ģŗĻČÜŅŗÖŠµĪ¼ÓBaCl2ČÜŅŗ£¬BaSO4ĻČĪö³ö | ||||||||
| B£®BaCO3µÄŠü×ĒŅŗÖŠ¼ÓČėÉŁĮæµÄŠĀÖĘĀČĖ®£¬c£ØBa2+£©Ōö“ó | ||||||||
C£®BaSO4ŗĶBaCO3¹²“ęµÄŠü×ĒŅŗÖŠ
| ||||||||
| D£®BaSO4Šü×ĒŅŗÖŠ¼ÓČėNa2CO3ÅØČÜŅŗ£¬BaSO4²»æÉÄÜ×Ŗ»ÆĪŖBaCO3 |
c(S
| ||
c(C
|
| Ksp(BaSO4) |
| Ksp(BaCO3) |
| 1 |
| 26 |


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Cu£ØOH£©2£¾CuCO3£¾CuS | B£®Cu£ØOH£©2£¼CuCO3£¼CuS |
| C£®CuS £¾Cu£ØOH£©2£¾CuCO3 | D£®CuS £¼Cu£ØOH£©2£¼CuCO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| O | 2-3 |
| O | 2-6 |
| ĪļÖŹ | Cu£ØOH£©2 | Fe£ØOH£©3 | CuCl | CuI |
| Ksp | 2.2”Į10-20 | 2.6”Į10-39 | 1.7”Į10-7 | 1.3”Į10-12 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®²ŠĮōŌŚŃĄ³ŻÉĻµÄĢĒ·¢½Ķ»į²śÉśH+£¬¾³£³ŌĢĒŅ×Ōģ³ÉČ£³Ż |
| B£®ÓÉÉĻŹöĘ½ŗāæÉÖŖ£¬Š”ŗ¢³¤ŃĄŹ±ŅŖÉŁ³ŌĢĒ¶ą²¹øĘ |
| C£®Čō¼õŠ”OH-µÄÅØ¶Č£¬ÉĻŹöĘ½ŗā½«ĻņÓŅŅĘ¶Æ£¬KspµÄÖµĻąÓ¦Ōö“ó |
| D£®Ź¹ÓĆŗ¬·śŃĄøąÄÜ·ĄÖ¹Č£³Ż£¬ŹĒŅņĪŖCa5£ØPO4£©3OH£Øs£©×Ŗ»ÆĪŖøüÄŃČܵÄCa5£ØPO4£©3F£Øs£©[Ca5£ØPO4£©3F£Øs£©µÄKsp=2.8”Į10-61mol9?L-9] |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| 2-3 |
| A£®xŹżÖµĪŖ2”Į10-5 |
| B£®cµćŹ±ÓŠĢ¼ĖįøĘ³ĮµķÉś³É |
| C£®¼ÓČėÕōĮóĖ®æÉŹ¹ČÜŅŗÓÉdµć±äµ½aµć |
| D£®bµćÓėdµć¶ŌÓ¦µÄČܶȻżĻąµČ |
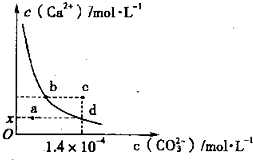
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
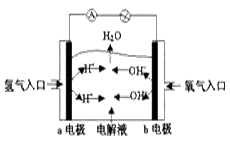
| A£®aµē¼«ŹĒøŗ¼« |
| B£®bµē¼«µÄµē¼«·“Ó¦ĪŖ£ŗ4OH--4e-==2H2O+O2”ü |
| C£®ĒāŃõČ¼ĮĻµē³ŲŹĒŅ»ÖÖ¾ßÓŠÓ¦ÓĆĒ°¾°µÄĀĢÉ«µēŌ“ |
| D£®ĒāŃõČ¼ĮĻµē³ŲŹĒŅ»ÖÖ²»ŠčŅŖ½«»¹Ō¼ĮŗĶŃõ»Æ¼ĮČ«²æ“¢“ęµē³ŲÄŚµÄŠĀŠĶ·¢µē×°ÖĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
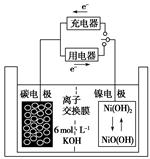
| A£®·ÅµēŹ±K£«ŅĘĻņøŗ¼« |
| B£®·ÅµēŹ±µē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ£ŗH2£2e£=2H£« |
| C£®·ÅµēŹ±µē³ŲÕż¼«µÄµē¼«·“Ó¦ĪŖ£ŗNiO£ØOH£©£«H2O£«e£=Ni£ØOH£©2£«OH£ |
| D£®øƵē³Ų³äµēŹ±½«Ģ¼µē¼«ÓėµēŌ“µÄÕż¼«ĻąĮ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®0.3mol | B£®0.05mol | C£®0.2mol | D£®0.1mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com