
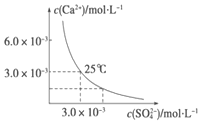
 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )| A. | 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 | |
| B. | 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| C. | 溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| D. | 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
分析 CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,c(SO42-)增大,CaSO4(s)?Ca2+(aq)+SO42-(aq)逆向移动,以此来解答.
解答 解:CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,c(SO42-)增大,CaSO4(s)?Ca2+(aq)+SO42-(aq)逆向移动,则析出CaSO4沉淀,最终溶液中c(SO42-)较原来大,c(Ca2+ )减小,
故选A.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
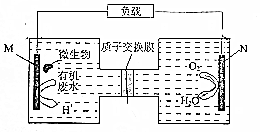 微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,如图是利用一种微生物将有机废水中的尿素[CO(NH2)3]转化为对环境无害物质的装置.下列叙述错误的是( )| A. | M电极有CO2和N2生成 | B. | H+透过质子交换膜由左向右移动 | ||
| C. | 微生物促进了反应中电子的转移 | D. | N电极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
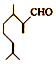 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水发生加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7 | |
| C. | pH为a的CH3COOH溶液和pH为b的NaOH溶液混合后溶液显酸性,则a一定大于b | |
| D. | 将10mLpH=a的盐酸与100 mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com