
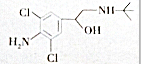
| A. | 该物质含有苯环,属于芳香族化合团 | |
| B. | 该物质只含有-OH,-NH2两种官能团 | |
| C. | 该物质含有-OH,就具有-OH的性质 | |
| D. | 该物质能发生氧化反应 |
分析 A、含苯环,叫属于芳香族化合物;
B、该物质只含有-OH,-NH2、-Cl三种官能团;
C、官能团是决定物质化学性质的原子团;
D、与羟基相连碳上有氢,所以可能发生催化氧化反应.
解答 解:A、含苯环,该物质属于芳香族化合物,故A正确;
B、该物质只含有-OH,-NH2、-Cl三种官能团,而不是两种,故B错误;
C、官能团是决定物质化学性质的原子团,所以该物质含有-OH,就具有-OH的性质,故C正确;
D、与羟基相连碳上有氢,所以可能发生催化氧化反应,生成羰基化合物,所以该物质能发生氧化反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重有机物性质及分析与应用能力的考查,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 | |
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H20+O2+4e-═4OH- | |
| C. | 在轮船底镶嵌锌块以保护船体,利用的是牺牲阳极保护法 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒感染,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响,PM2.5引起的雾霾一定属于气溶胶. | |
| C. | 陶瓷、玻璃和光导纤维都是硅酸盐材料 | |
| D. | 原子结构模型的演变经历了: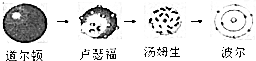 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 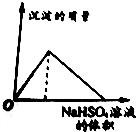 | B. | 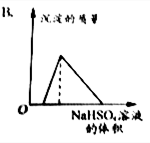 | ||
| C. |  | D. | 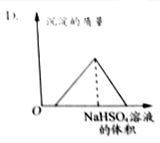 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com