
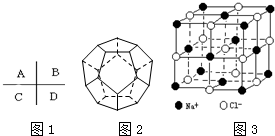
分析 (1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;同一主族元素,元素第一电离能随着原子序数增大而减小;
(2)该分子中每个五边形含有C原子个数=$\frac{1}{3}$×5=$\frac{5}{3}$,正五边形个数=20÷$\frac{5}{3}$;每个碳原子占有边数=$\frac{1}{2}$×3=1.5;由分子构成的物质是分子晶体;
(3)晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时吸引着6个Na+,晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有12个.
解答 解:(1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;同一主族元素,元素第一电离能随着原子序数增大而减小,所以这几种元素第一电离能最小的是C,故答案为:C;
(2)该分子中每个五边形含有C原子个数=$\frac{1}{3}$×5=$\frac{5}{3}$,正五边形个数=20÷$\frac{5}{3}$=12;每个碳原子占有边数=$\frac{1}{2}$×3=1.5,该结构中边数=1.5×20=30;由分子构成的物质是分子晶体,该物质是由分子构成的,为分子晶体,
故答案为:12;30;分子晶体;
(3)根据图知,以体心上的离子为中心,与其距离最近的相反电荷的离子有6个、与其距离最近的相同电荷的离子为12,所以晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时吸引着6个Na+,晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有12个C,
故答案为:6;6;12.
点评 本题考查晶胞计算及元素周期律,为高频考点,明确物质结构及均摊分的利用运用是解本题关键,侧重考查学生分析计算能力,注意(2)的计算方法,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
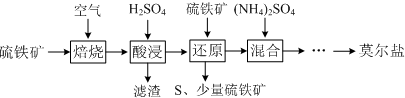
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的盐溶液一定显酸性 | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | X、W分别形成的简单气态氢化物可反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
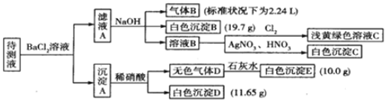
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学变化中一定发生物理变化 | |
| B. | 蓄电池充电时,电能转变成化学能 | |
| C. | 人类利用的能量都是通过化学反应获得的 | |
| D. | 有颜色改变的变化一定是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com