
地壳中含量第一和第二的两元素形成的化合物,不具有的性质是 ( )。
A.在一定条件下可与NaOH溶液反应
B.与碳在高温下反应可制取两元素中的一种单质
C.熔点很高,可用作耐火材料
D.是酸酐,与水反应生成相应的酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高二化学人教版选修二 4单元综合检测练习卷(解析版) 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要__________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: ______________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有____________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是__________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
(5)上述工艺流程中体现的绿色化学理念是____________________________
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.3 高分子化合物与材料练习卷(解析版) 题型:选择题
复合材料的使用使导弹的射程有了很大的提高,其主要原因是 ( )。
A.复合材料可以使导弹经受高温的变化
B.复合材料可以使导弹质量减小
C.复合材料可以使导弹承受超高强度的变化
D.复合材料可以承受空气的巨大摩擦
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.2 金属材料练习卷(解析版) 题型:选择题
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )。
A.溶液A和B均可以是盐酸
B.溶液A和B均可以是NaOH溶液
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.1 无机非金属材料练习卷(解析版) 题型:选择题
有关材料用途的说法中不正确的是 ( )。
A.氧化铝陶瓷可用作高压钠灯的灯管
B.氮化硅陶瓷可用作陶瓷发动机的材料
C.光导纤维可用作遥测遥控、照明等
D.氧化铝陶瓷可用作半导体材料
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 2单元综合检测练习卷(解析版) 题型:填空题
水处理技术在生产、生活中应用广泛。
(1)含有较多________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为____________(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或“ROH”)型离子交换树脂,原因是__________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为____________。电渗析法净化水时,使离子通过半透膜的推动力是__________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的__________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 2单元综合检测练习卷(解析版) 题型:选择题
污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有 ( )。
A.①②③ B.①②④
C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:选择题
世界上60%的镁是从海水中提取的,其主要步骤如下:①把贝壳制成石灰乳 ②在海水中加入石灰乳,过滤,洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤 ④在氯化氢热气流中干燥晶体 ⑤电解上述晶体的熔融物。下列说法不正确的是 ( )。
A.镁元素在元素周期表中位于第3周期,ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是抑制MgCl2水解
D.步骤⑤也可以采用电解该晶体水溶液的方法
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 1.2 人工固氮合成氨练习卷(解析版) 题型:填空题
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
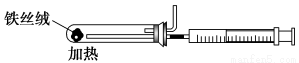
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
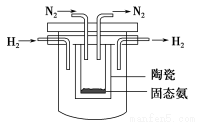
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com