
����Ŀ������������������ڹ�ũҵ�������й㷺Ӧ�á�
��1�������⣨MoS2)����Ҫ�Ĺ�������
�����Ϊ2L�ĺ����ܱ������м���0.1molMoS2��0.2molNa2CO3��������0.4molH2��
������Ӧ:MoS2(s)+2Na2CO3(s)+4H2(g)![]() Mo(s) +2CO(g) + 4H2O(g) + 2Na2S(s) ��H =akJ mol-1������ڲ�ͬ�¶��´ﵽƽ��ʱ����������ʵ���������ͼ��ʾ��
Mo(s) +2CO(g) + 4H2O(g) + 2Na2S(s) ��H =akJ mol-1������ڲ�ͬ�¶��´ﵽƽ��ʱ����������ʵ���������ͼ��ʾ��

��a________0���<����>����=��,��ͬ����
�������ڵ���ѹ��P��________Q�㡣
��P���Ӧ�¶��£�H2��ƽ��ת����Ϊ________��ƽ�ⳣ��K=________��
��2����ͭ����Ҫ�ɷ���Cu2S)��ұ�������л����������SO2����֪ұ�������в��ַ�ӦΪ��
��2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ��H=-768.2kJ/mol
��2Cu2O+Cu2S(s)=6Cu(s)+SO2(g) ��H=+116kJ/mol����Cu2S��O2��Ӧ����Cu��SO2���Ȼ�ѧ����ʽΪ___________________________��
��3�����մ���SO2�ķ���֮һ���ð�ˮ����ת��ΪNH4HSO3����֪������ Kb(NH3H2O) =1.5��l0-5 Ka1(H2SO3) =1.6��l0-2 Ka2(H2SO3)=1��10-7�������չ����а�ˮ��SO2ǡ����ȫ��Ӧ����������Һ�ڳ����µ�pH________7(�>���� <����=������ͬ������Һ��c(SO32-)________c(H2SO3)��

��4����500��������立ֽ��õ�4�ֲ���京�����ʵ����ʵ�����ʱ��ı仯����ͼ��ʾ���������������立ֽ�Ļ�ѧ����ʽΪ_________________________��
���𰸡� > < 50% 0.0025 Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ��H= -217.4kJ/mol < > 3(NH4)2SO4![]() N2��+4NH3��+3SO2��+6H2O��
N2��+4NH3��+3SO2��+6H2O��
��������(1)������ͼ��P����Q�㣬����������Q���൱�������¶ȣ����������������С��������ӦΪ���ȷ�Ӧ����a��0���ʴ�Ϊ������
��Q���P��������ı���������Ӧ���ʴ���P�㣬�ʲ���������࣬ѹǿ�������ڵ���ѹ��P�㣼Q�㣬�ʴ�Ϊ������
���������������㣬��MoS2�仯�����ʵ���Ϊx��
MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)��
��ʼ��mol��0.1 0.2 0.4 0 0 0 0
��Ӧ x 2x 4x x 2x 4x 2x
ƽ�� 0.1-x 0.2-2x 0.4-4x x 2x 4x 2x
P��ʱ���������ʵ�������Ϊ40%����![]() ��100%=40%��x=0.05��H2��ƽ��ת����=
��100%=40%��x=0.05��H2��ƽ��ת����=![]() ��100%=0.05��100%=50%�� P���ƽ�ⳣ��K=
��100%=0.05��100%=50%�� P���ƽ�ⳣ��K=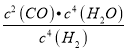 =
=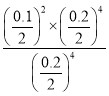 =2.5��10-3���ʴ�Ϊ��50%��0.0025��
=2.5��10-3���ʴ�Ϊ��50%��0.0025��
(2)��2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ��H=-768.2kJ/mol ����2Cu2O+Cu2S(s)=6Cu(s)+SO2(g) ��H=+116kJ/mol�����ݸ�˹���ɣ�����+���ã�3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g) ��H=(-768.2kJ/mol)+(+116kJ/mol)=-652.2 kJ/mol����Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ��H= -217.4kJ/mol���ʴ�Ϊ��Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ��H= -217.4kJ/mol��
(3)���ݳ����� Kb(NH3H2O) =1.5��l0-5 Ka1(H2SO3) =1.6��l0-2 Ka2(H2SO3)=1��10-7����֪笠����ӵ�ˮ��ƽ�ⳣ��=![]() =
=![]() ��l0-9��������������ӵĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ�NH4HSO3��Һ�����ԣ�pH��7����������������ӵĵ���Ϊ������Һ��c(SO32-)��c(H2SO3) ����Ϊ��< ��>��
��l0-9��������������ӵĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ�NH4HSO3��Һ�����ԣ�pH��7����������������ӵĵ���Ϊ������Һ��c(SO32-)��c(H2SO3) ����Ϊ��< ��>��
(4)��500��������立ֽ�����еõ�4�ֲ���京��������ʱ��仯��ϵ��ͼ����ʾ������立ֽ����ɵ��������������������ˮ����ϵ����غ��ԭ���غ���ƽ��д�õ���ѧ����ʽΪ��3(NH4)2SO4![]() N2��+4NH3��+3SO2��+6H2O�����ʴ�Ϊ��3(NH4)2SO4
N2��+4NH3��+3SO2��+6H2O�����ʴ�Ϊ��3(NH4)2SO4![]() N2��+4NH3��+3SO2��+6H2O������
N2��+4NH3��+3SO2��+6H2O������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������йص������Һ��˵����ȷ����( )
A. ��Na2CO3��Һ��ˮϡ�ͺ�pH���Kw����
B. ����AgCl����ı�����Һ�м�����ˮ��c(Ag+)��Ksp(AgCl)������
C. pH=4.75Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��CH3COONa�Ļ����Һ�У�c(CH3COO��)+c(OH��)
<c(H+)+c(CH3COOH)
D. �ֱ���pH=2��pH=3 �� CH3COOH��Һ�к͵����ʵ�����NaOH������CH3COOH��Һ������ֱ�ΪVa��Vb����10Va=Vb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1��д�����и��л���Ľṹ��ʽ
��2������1����ϩ��_______________________��
��֧��ֻ��һ���һ���ʽ����С������____________
��������ʽΪC4H6��ij�������е�̼ԭ�Ӷ���ͬһ��ֱ���ϣ�������Ľṹ��ʽΪ______________
��2������л���ṹ�ص���������������жϣ�
���ºϳɵ�����A����Է�������������100������C��H�����������ֱ�Ϊ��w(C)��69.76%��w(H)��11.63%������ȫȼ�պ����ֻ��CO2��H2O����A��Ħ������Ϊ_________���йض�����A�ṹ��Ԥ�⣬����ȷ���� _______������ţ���
A�����ܺ���һ��̼̼˫����һ���ǻ� B�����ܺ���һ��̼����һ��ȩ��
C������ֻ��һ��̼��˫�������� D�������ǻ�״����
�� ��H2��1:1�����ӳɷ�Ӧ�ɵõ�_____�ֲ�ͬ�ṹ�IJ��
��H2��1:1�����ӳɷ�Ӧ�ɵõ�_____�ֲ�ͬ�ṹ�IJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǿ������˳����ȷ����
��O��H��O ��N��H��N ��F��H��F ��O��H��N
A. �٢ڢۢ�B. �ۢ٢ܢ�C. �ۢڢܢ�D. �ۢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2C2O4)��һ����Ҫ���л�����ԭ�ϡ�Ϊ̽���������ȡ�����ʼ�Ӧ�ã���������ʵ�顣
ʵ����ᾧ����Ʊ�
ʵ������������������ˮ��Һ���Ʊ����ᣬװ�D��ͼ��ʾ��

��һ�����ĵ���ˮ��Һ����������ƿ��
�ڿ��Ʒ�Ӧ�¶�55-60�棬�߽�������μ�һ�����Ļ����
�۷�Ӧ3Сʱ����ȴ�����˺����ؽᾧ�õ����ᾧ�塣
��1����ͼʵ��װ��������������Ϊ________������ˮ�Ľ�����________������a������b�� ����
��2����������Ƿ�ˮ����ȫ����Ҫ���Լ�Ϊ______________��
ʵ���̽�����������Ը��������Һ�ķ�Ӧ
��3���������Һ����μ��������ữ�ĸ��������Һʱ���ɹ۲쵽��Һ���Ϻ�ɫ��Ϊ������ɫ�����Ʋ������ܾ���________�ԡ���Ӧ���ʿ�ʼ�����������ӿ죬���ܵ�ԭ����_________��д����Ӧ�����ӷ���ʽ________________��
ʵ��������ʵ�Ӧ��
���ñ�H2C2O4������KMnO4��Һ��Ӧ̽���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣��ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������Ʒ������£�
��� | H2C2O4��Һ | ���Ը��������Һ | �¶�/�� | ||
Ũ��/molL-1 | ���/mL | Ũ��/molL-l | ���/mL | ||
�� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
��4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��Һ��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪn(H2C2O4)��n(KMnO4)��________��
��5��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������___________��̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������__________��
ʵ��������ᾧ���нᾧˮ�ⶨ
���ᾧ��Ļ�ѧʽ�ɱ�ʾΪH2C2O4xH2O��Ϊ�ⶨx��ֵ����������ʵ�飺
�ٳ�ȡ6.3gij���ᾧ�����100. 0mL��ˮ��Һ��
��ȡ25.00mL������Һ������ƿ�У���������ϡH2SO4,��Ũ��Ϊ0.5ml/L��KMnO4��Һ�ζ����ζ��յ�ʱ����KMnO4�����Ϊ10.00mL��
��6������x= ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ㷺Ӧ�������Ϻ�װ�β��ϡ��ϳɵ��ڵķ�Ӧ���£�
![]()
����˵����ȷ����
A. �ϳɵ��ڵķ�ӦΪ�Ӿ۷�Ӧ
B. �Ա�������ͱ����ụΪͬϵ��
C. 1 mol������NaOH��Һ��Ӧ����������������2n mol NaOH
D. ���ڵĽṹ��ʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ����������������Ԫ��W���Ʊ�һ�ָ�Ч��ص���Ҫ���ϣ� Xԭ�ӵ��������������ڲ��������2����Ԫ��Y�ǵ����к�����ḻ�Ľ���Ԫ�أ�Zԭ�ӵ�����������������Ӳ�����2��������˵���������� �� ��
A. Ԫ��Z����Ԫ��X�γɹ��ۻ�����XZ2
B. Ԫ��X�����γɵ�ԭ�ӱ�Ϊ1:1�Ļ������кܶ���
C. Ԫ��W��X���Ȼ����У���ԭ�Ӿ�����8���ӵ��ȶ��ṹ
D. Ԫ��Y�ĵ���������������Һ�����ᷴӦ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ��������Ϣ��գ�
(1)ij�л����ü���ʽ![]() ��ʾ�ķ���ʽ__________________��
��ʾ�ķ���ʽ__________________��
ϵͳ��������������_________________________________________��
��2������A��ͬ�¡�ͬѹ���������ܶ���H2��43���������ʽΪ___________��
��3��C4H9Cl�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣬��A�Ľṹ��ʽΪ____________��
��4��1molij�����������Ժ�1molCl2�����ӳɷ�Ӧ������2-��-2,3-�������飬���
���������ṹ��ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com