
����Ŀ������˵����ȷ����
A��H2(g)+Br2(g)=2HBr(g) ��H��-72 kJ��mol-1��������������±���

�����aΪ230
B����֪��H+(aq)+OH-(aq)=H2O(l)��H��-57.3kJ��mol-1
����![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l)��H��-57.3kJ��mol-1
BaSO4(s)+H2O(l)��H��-57.3kJ��mol-1
C����֪CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H��-802.33kJ��mol-1����CH4��ȼ����Ϊ802.33kJ��mol-1
D����֪2C(s)+2O2(g)=2CO2(g)��H1��2C(s)+O2(g)=2CO(g)��H2����H1>��H2
���𰸡�A
��������
���������A.��H2(g)+Br2(l)=2HBr(g)��H=-72kJ/mol��Ӧ�У���Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ���������ܼ��ܣ�����H=��Ӧ����ܼ���-��������ܼ���=436+a-2��369=-72��a=-2240����1molBr2(g)�еĻ�ѧ������ʱ��Ҫ���յ�����230kJ����A��ȷ��B����Ӧ�������ᱵ����Ҫ�ų���������˦�H��-57.3 kJ��mol-1����B����C��CH4��ȼ����ָ���ɵ�ˮΪҺ�壬��C����D��������̼��ȫȼ�շų����������ڲ���ȫȼ�գ��ų�������Խ�࣬��HԽС����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ����������̿����ʹƷ����Һ��ɫ�����ǵ�Ư��ԭ����ͬ
B. �����������������ڵ糡��Ӱ���½��������ƶ���˵������������������硣
C. ��ij��Һ�м���NaOH��Һ���ٵμӺ�ɫʯ����Һ����˵����Һ�к���NH4+
D. ��֪298Kʱ���ϳɰ���ӦN2(g) +3H2(g)![]() 2NH3(g) ��H��-92.0kJ/mol �����ܱ������м���һ������Ӧ���ƽ�������0.2mol NH3����÷�Ӧ�ų�������Ϊ9.20kJ
2NH3(g) ��H��-92.0kJ/mol �����ܱ������м���һ������Ӧ���ƽ�������0.2mol NH3����÷�Ӧ�ų�������Ϊ9.20kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
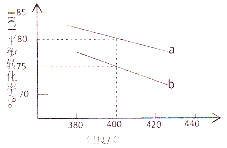
����Ŀ�����ڷ�Ӧ��4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)����ͼ������Ͷ�ϱ�[n(HCl)��(O2)�ֱ�Ϊ4��1��2:1]�£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߡ���Ͷ�ϱ�Ϊ4:1�����Ϊ400��ʱ��ƽ��������Cl2�����������( )
2Cl2(g)+2H2O(g)����ͼ������Ͷ�ϱ�[n(HCl)��(O2)�ֱ�Ϊ4��1��2:1]�£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߡ���Ͷ�ϱ�Ϊ4:1�����Ϊ400��ʱ��ƽ��������Cl2�����������( )
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���( )
A����NO2(g)��N2O4(g)��ɵ�ƽ����ϵ�����¶Ⱥ���ɫ����
B��ʵ���������Ȼ��ƹ�����Ũ���Ṳ����ȡHCl����
C��ʵ���ҿ���̼��Ʒ�ĩ��ϡ�����Ƶ�CO2����
D��ʵ�������ű���ʳ��ˮ�ķ����ռ�Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ʵ������֤����ˮ���������
A. ��ˮ�ܸ��Ȼ�����Һ��Ӧ����������������
B. ��������ֽ�
C. 1mol/L �İ�ˮ����ʹ��̪��Һ���
D. ������0.1mol/L���Ȼ����Һ��pHΪ5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�ܱ������У�1 mol A��3 mol B��һ�������·�Ӧ��A��������xB������![]() 2C��������2min��Ӧ�ﵽƽ��ʱ����û�����干3��4 mol������0��4 mol C�������м���������ȷ���ǣ� ��
2C��������2min��Ӧ�ﵽƽ��ʱ����û�����干3��4 mol������0��4 mol C�������м���������ȷ���ǣ� ��
A. ƽ��ʱ�����ʵ�����A��B��C��2��11��4
B. xֵ����4
C. B��ƽ����Ӧ����Ϊ0��04 mol��L-1��min-1
D. A��ת����20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǿ����ʵ��� �� ��
A. NH3��H2O B. H2O C. CH3COOH D. CH3COONH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7��������
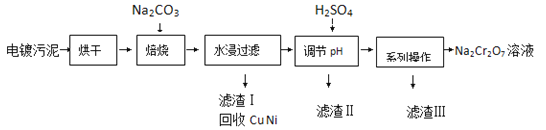
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի�������
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�����±���
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ ��ˮ������Һ�г�Na2CrO4�����ڵ������� �� ��
��2������H2SO4����pH��Ŀ��Ϊ ��
��3���õ��������ġ�ϵ�в������IJ���Ϊ �� ���ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72������ת����������Һ��c��Cr2O72���� = molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2���ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5��������Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ������ǵĻ���Ԫ�ض���C��H��O��N
B. ���ǵĺϳɹ����ж���ˮ����
C. ���ǵĽṹ�������������������
D. ���Ƿ��ӵĶ�������ϸ�������Եĸ���ԭ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com