
下列关于氧化还原反应的说法,正确的是
A.氧化还原反应的特征是电子的转移
B.氧化剂在反应中被还原,生成氧化产物
C.同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数
D.任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
分析下列反应,在任何温度下均能自发进行的是
A.2N2(g)+O2(g)===2N2O(g)ΔH=+163 kJ·mol-1
B.Ag(s)+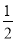 Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+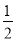 O2(g)ΔH=+91 kJ·mol-1
O2(g)ΔH=+91 kJ·mol-1
D.H2O2(l)=== 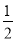 O2(g)+H2O(l)ΔH=-98 kJ·mol-1
O2(g)+H2O(l)ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Fe2O3溶于HI溶液中:Fe2O3 + 6H+ =2Fe3++ 3H2O
B.[Ag(NH3)2]OH的溶液中加入盐酸:Ag+ + Cl-= AgCl↓
C.Na2S2O3溶液吸收Cl2:4Cl2 + S2O32-+5H2O= 10H+ + 2SO42- + 8Cl-
D.(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++ Fe2++3OH-=Fe (OH)2↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知化学反应2C(s)+O2(g) 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)  2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.28gCO所具有的能量一定高于12gC所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份等质量碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:填空题
铁是应用最广泛的金属,铁的卤化物也是一种重要化合物。
(1)在实验室中,FeCl2可用铁粉和___________反应制取,FeCl3可用铁粉和___________反应制取。现有含FeCl2和FeCl3的混合物样品,测得n(Fe):n(Cl)=1:2.4,则该样品中FeCl3的物质的量分数为________________。
(2)FeCl2易被氧化,检验一瓶FeCl2溶液是否被氧化的方法(写出操作步骤、现象及结论)是______________。向FeCl2溶液中加入NaOH溶液,开始时生成白色沉淀,后马上变成灰绿色,最终变成红褐色,沉淀变色发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期9月月考化学试卷(解析版) 题型:计算题
在标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量比。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:计算题
(8分)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为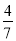 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月第一次月考化学试卷(解析版) 题型:选择题
将钠、铝、铁各1mol分别投入到等体积且同浓度的盐酸中,产生的氢气体积在相同条件下
A、钠可能最多 B、铝铁不可能一样多
C、铝一定最多 D、无法判断
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
(14分)铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石的混合物。某化学兴趣小组从铁砂中分离出磁性氧化物,并进行铝热反应实验。
 (1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是_________________现象很壮观,取少许生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现结果的原因,除了可能混有没有反应的磁性氧化铁外,还有一个原因是____________设计一个简单的实验方案,证明上述所得“铁块”中含有金属铝。该实验所用的试剂 是____________,反应的离子方程式_____________________
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是_________________现象很壮观,取少许生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现结果的原因,除了可能混有没有反应的磁性氧化铁外,还有一个原因是____________设计一个简单的实验方案,证明上述所得“铁块”中含有金属铝。该实验所用的试剂 是____________,反应的离子方程式_____________________
(2)写出此铝热反应的化学方程式:___________________________每摩尔单质铝参与反应,转移的电子数为___________________
(3)除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以( )
A.CuO B.Na2O2 C .MnO2 D.MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com