
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①非金属性越强,对应氢化物越稳定;
②电子层越多,原子半径越大,同周期从左向右原子半径减小;
③非金属性越强,对应最高含氧酸的酸性越强;
④非金属性越强,对应阴离子的还原性越弱.
解答 解:①因元素的非金属性越强其对应的氢化物越稳定,非金属性:F>O>S,所以HF>H2O>H2S,故①错误;
②因同周期元素的半径从左至右逐渐减小,Na>Mg,O在Na和Mg的上一周期,半径最小,故②正确;
③因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,酸性:HClO4>H2SO4>H3PO4,故③错误;
④非金属性Cl>Br>I,还原性:I->Br->Cl-,故④正确;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的性质、元素周期律为解答本题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | SO2(HCl):NaOH溶液 | D. | NaHCO3溶液(Na2CO3):Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
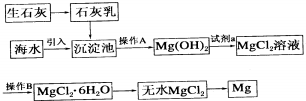
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )| A. | ①③④⑤⑥⑦ | B. | ②③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

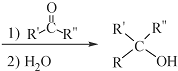
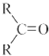 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$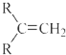 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)  .写出A中含氧官能团的名称:羟基
.写出A中含氧官能团的名称:羟基 或
或 .(不考虑环状结构)
.(不考虑环状结构) .
.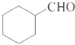 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$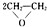 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com