
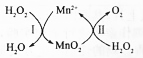
 MnSO4������������������Ԫ�ط��ϵȣ��ش��������⣺
MnSO4������������������Ԫ�ط��ϵȣ��ش��������⣺���� ��1�������̿�����Һ����Ҫ��MnO2�����������ԣ�ͨ���������������л�ԭ�ԣ�������Һ�ж��������������������ϼ۽������������̣�����������������Ԫ�ػ��ϼ�����Ϊ+6�����ɲ���Ϊ���
��2����������Һ������Mn2+��Fe2+�����ӣ��еμ�Na2S��Һ����MnS��ʼ����ʱ�������ܶȻ�������������������ȫ��������ſ�ʼ����MnS�����ݳ���������ܶȻ�������������Ũ�ȱ�ֵ��
��3��ת����ϵ��֪����������������ӷ�Ӧ�õ��������̺������ӣ������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��� �⣺��1�������̿�����Һ����Ҫ��MnO2�����������ԣ�ͨ���������������л�ԭ�ԣ�������Һ�ж��������������������ϼ۽������������̣�����������������Ԫ�ػ��ϼ�����Ϊ+6�����ɲ���Ϊ���ᣬ������������������ΪH2SO4��
�ʴ�Ϊ��H2SO4��
��2����������Һ������Mn2+��Fe2+�����ӣ��еμ�Na2S��Һ����MnS��ʼ����ʱ�������ܶȻ�������������������ȫ��������ſ�ʼ����MnS�����ݳ���������ܶȻ�������������Ũ�ȱ�ֵ��FeS+Mn2+=MnS+Fe2+��K=$\frac{c��F{e}^{2+}��}{c��M{n}^{2+}��}$=$\frac{c��F{e}^{2+}��}{c��M{n}^{2+}��}$��$\frac{c��{S}^{2-}��}{c��{S}^{2-}��}$=$\frac{Ksp��FeS��}{Ksp��MnS��}$=$\frac{7.0��1{0}^{-18}}{1.4��1{0}^{-15}}$=5��10-3��
�ʴ�Ϊ��5��10-3��
��3��ת����ϵ��֪����������������ӷ�Ӧ�õ��������̺������ӣ�
2H2O2��l���T2H2O��l��+O2��g����H1�٣�
MnO2��s��+H2O2��l��+2H+�TMn2+��aq��+O2��g��+2H2O��l����H2����
���ݸ�˹���ɢ�-�ڵõ�H2O2��l��+Mn2+��aq���TMnO2��s��+2H+��aq����H=��H1-��H2
�ʴ�Ϊ��H2O2��l��+Mn2+��aq���TMnO2��s��+2H+��aq����H=��H1-��H2��
���� ���⿼����������ԭ��Ӧ����˹���ɺ��Ȼ�ѧ����ʽ���㣬�����ܽ�ƽ����ܶȻ������ļ���Ӧ�ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2�ͳ���ʯ��ˮ��Ӧ��Cl2+2OH-�TCl-+ClO-+H2O | |
| B�� | NaHCO3��Һ��NaOH��Һ��Ӧ��OH-+HCO3-�TCO2��+H2O | |
| C�� | ��AlCl3��Һ�м�������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| D�� | ʵ�����ô���ʯ��ϡ������ȡCO2��CaCO3+2H+�TCa2++CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
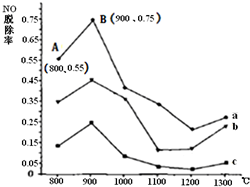 ����[CO��NH2��2]��һ������������Ч��NOת��ΪN2����ͼΪCO��NH2��2��ij����������ҪΪN2��NO����NO�����ʵ�����ֵ�ֱ�Ϊ1��2��2��1��3��1ʱ��NO�ѳ��ʣ�NO����������NO��ԭʼ���ı�ֵ�����¶ȱ仯������ͼ��
����[CO��NH2��2]��һ������������Ч��NOת��ΪN2����ͼΪCO��NH2��2��ij����������ҪΪN2��NO����NO�����ʵ�����ֵ�ֱ�Ϊ1��2��2��1��3��1ʱ��NO�ѳ��ʣ�NO����������NO��ԭʼ���ı�ֵ�����¶ȱ仯������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
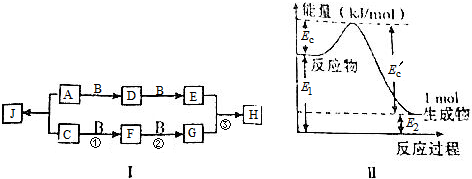
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڿ������п������ƣ���������䰵��2Na+O2�TNa2O2 | |
| B�� | ���Ȼ�����Һ�м��������ˮ��������ɫ������Al3++3OH-�TAl��OH��3�� | |
| C�� | ��������ˮ�������ȣ��������壺2Fe+3H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+3H2 | |
| D�� | ��Ͷ�뵽ˮ�У��������壺2Na+2H2O�T2NaOH+H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com