
 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.| 1.4212kJ |
| 0.025mol |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、将电源反接前a极发生的反应为:2H++2e-=H2↑ |
| B、将电源反接后,a极发生的反应只有Cu2++2 e-=Cu |
| C、整个电解过程只产生一种气体 |
| D、原硫酸铜溶液的浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
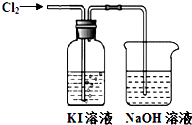 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:| 操作 | 实验现象 | |
| a | 取2~3 mL黄色溶液,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层显浅黄色. |
| b | 取2~3 mL饱和碘水,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层几近无色. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com