
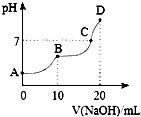
 25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )
25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )| A. | C点溶液中含有NaHC2O4和Na2C2O4 | |
| B. | NaHC2O4溶液中水的电离程度比Na2C2O4溶液中小 | |
| C. | B点,c (Na+)=2[c (H2C2O4)+c (HC2O4-)+c (C2O42-)] | |
| D. | D点,c (Na+)>c (C2O42-)>c (OH-)>c (HC2O4-)>c (H+) |
分析 A.10mL 0.1mol•L-1 H2C2O4溶液与等浓度NaOH完全反应生成Na2C2O4,消耗NaOH的体积为20mL;
B.多元弱酸根离子分步水解,以第一步水解为主;
C.根据物料守恒分析;
D.D点,H2C2O4溶液与NaOH恰好反应生成Na2C2O4,溶液显碱性.
解答 解:A.10mL 0.1mol•L-1 H2C2O4溶液与等浓度NaOH完全反应生成Na2C2O4,消耗NaOH的体积为20mL,此时溶液显碱性,C点溶液显中性,消耗的NaOH的体积小于20mL,所以溶液中溶质为NaHC2O4和Na2C2O4,故A正确;
B.多元弱酸根离子分步水解,以第一步水解为主,所以NaHC2O4溶液中水的电离程度比Na2C2O4溶液中小,故B正确;
C.B点,H2C2O4溶液与NaOH恰好反应生成NaHC2O4,由物料守恒可知,c (Na+)=c (H2C2O4)+c (HC2O4-)+c (C2O42-),故C错误;
D.D点,H2C2O4溶液与NaOH恰好反应生成Na2C2O4,Na2C2O4水解溶液显碱性,以第一步水解为主,所以溶液中离子浓度关系为;c (Na+)>c (C2O42-)>c (OH-)>c (HC2O4-)>c (H+),故D正确.
故选C.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒分析,主要是图象变化和反应后溶液PH变化,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂 | |
| B. | 硅可制作半导体材料 | |
| C. | 氢氧化钠常用于中和胃酸 | |
| D. | 常温下,铁制容器可用于盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
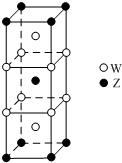 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.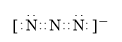 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
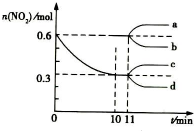 汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示
汽车尾气中CO、NO2在一定条件下可发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200KJ/mol,一定温度下,向容积固定为 2L的密闭容器中充入一定量的 CO和 NO2,NO2 的物质的量随时间的变化曲线如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者大于后者 | C. | 后者大于前者 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
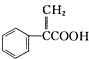
| A. | 阿托酸属于芳香烃化合物,与苯甲酸互为同系物 | |
| B. | 阿托酸分子中至少有6个碳原子处于同一平面上 | |
| C. | 1mol阿托酸最多能和1molBr2发生加成反应 | |
| D. | 阿托酸分子能发生取代、氧化、还原以及水解等反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
9月15日22时04分09秒,长征二号FT2火箭托举着天宫二号空间实验室腾空而起,成功送上太空。该火箭所用的推进燃料偏二甲肼(化学式为C2H8N2),下列说法中正确的是
A.lmolC2H8N2中含有lmolN2
B.偏二甲肼的摩尔质量为60g
C.偏二甲肼是比液氢更环保的燃料
D.偏二甲肼燃烧时能放出大量的热和气体
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1000mol•L1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com