
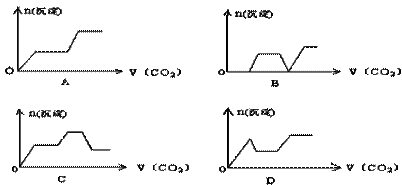
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
【知识点】二氧化碳的性质C1D5
【答案解析】C 解析:将二氧化碳气体通入含有氢氧化钾,氢氧化钙,KAlO2的混合溶液中,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图怎么画,我们可以先分析一下:
CO2先与Ca(OH)2反应(有沉淀CaCO3生成);当Ca(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成).到现在的图标应是出现沉淀(CaCO3),平台,沉淀增加[因有Al(OH)3生成];
过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使CaCO3沉淀溶解.最后是Al(OH)3沉淀.图形应该是:出现沉淀(CaCO3),平台,沉淀增加[Al(OH)3],平台,沉淀减少(CaCO3溶解).我可以据此作出正确的选择.
A、不符合沉淀、平台、沉淀增加、平台、沉淀减少、平台,故错误,不可选;
B、不符合沉淀、平台、沉淀增加、平台、沉淀减少、平台,错误,不可选;
C、符合沉淀、平台、沉淀增加、平台、沉淀减少、平台,正确,可选;
D、不符合沉淀、平台、沉淀增加、平台、沉淀减少、平台,错误,不可选 ;
故答案选C
【思路点拨】本题考查运用课本知识解决新问题的能力,并且要考虑二氧化碳的充足会使生成物继续反应的问题,属于偏难题 。


科目:高中化学 来源: 题型:
由一种阳离子与两种酸根离子组成的盐为混盐。混盐CaOCl2在酸性条件下可以产生Cl2下列关于混盐CaOCl2的有关判断正确的是
A.该混盐具有和漂白粉相似的化学性质
B.该混盐的水溶液呈中性
C.该混盐与硫酸反应产生1 mol Cl2时转移2 mol电子
D.该混盐中氯元素的化合价为-1价
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
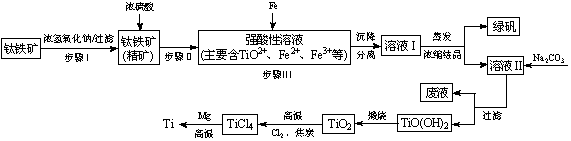
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
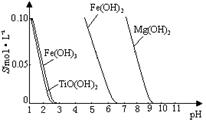 (2)已知:TiO2+易水解,只能存在于强酸性溶液中。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如右图,
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
 (3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
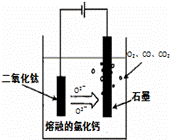
(4)电解TiO2制备钛的方法如右图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学一选修3:物质结构与性质】(15分)
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关。
(1)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,理由是 。
(2)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态碳原子的电子排布图 ,该物质的K原子和C60分子的个数比为 。
(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
(4)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式 ;两者相比较沸点高的为
(填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为 。
(5)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个Ni原子之间的最短距离为___________m(精确至0.01)。若晶体中的Ni分别为Ni2﹢、Ni3﹢,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3-
B.有大量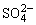 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量 存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO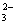 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列①~⑩中选出适宜的词语填入下列每小题的空格中(填编号):
①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳
⑧丁达尔现象 ⑨中和 ⑩水解
(1)肥皂水中透过强光,可以见到光亮的“通路”。这种现象称为___________。
(2)在制取肥皂时,加入食盐细粒使肥皂析出,这个过程称为_____________。
(3)在肥皂水中滴加酚酞,溶液变成红色,说明高级脂肪酸根离子发生了____________。
(4)在氢氧化铁胶体中加入浓硫酸铵溶液,产生红褐色沉淀,这种现象叫做___________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ/mol
根据上述反应,下列说法正确的是( )
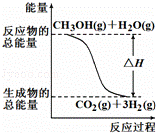
|
| A. | 反应①中的能量变化如图所示 |
|
| B. | CH3OH转变成H2的过程一定要吸收能量 |
|
| C. | 1mol CH3OH充分燃烧放出的热量为192.9kJ |
|
| D. | 可推知2H2(g)+O2(g)═2H2O(g)△H=﹣483.8 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com