
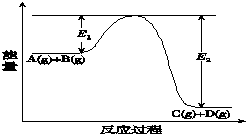
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
分析 (1)①E1代表的意义是反应物的活化能;反应中反应物的能量高于生成物的能量,反应是放热反应,焓变小于零,根据焓变的含义来回答;
②升高温度,化学反应向着吸热方向进行;
(2)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
②根据化学反应速率和化学平衡的影响因素进行判断.
解答 解:(1)①E1代表的意义是反应物的活化能;根据图中信息得到:反应物的能量高于生成物的能量,反应是放热反应,焓变=产物的能量-反应物的能量,图中,E1是普通分子变为活化分子吸收的能量,E2 是活化分子之间的反应生成产物的能量变化,E1-E2 是反应物和产物的能量之差,反应是放热的,所以焓变=E1-E2 <0,
故答案为:反应物的活化能;放热;E1-E2 ;
②当反应达到平衡时,升高温度,化学反应向着吸热方向进行,即逆向进行,所以反应物A的转化率减小,故答案为:减小;
(2)①A.v(NO2)正=v(O2)逆,反应速率之比与化学计量数之比不等,故A错误;
B.反应前后气体的体积不等,故容器内压强保持不变可作为判断是否达到化学平衡状态的依据,故B正确;
C.v(NO)逆=2v(O2)正,反应速率之比等于化学计量数之比,故v正=v逆,故C正确;
D.NO2为红棕色气体,O2和NO为无色气体,故容器内气体颜色不变可作为判断是否达到化学平衡状态的依据,故D正确,
故答案为:BCD;
②A.升高温度,平衡逆向移动,故A错误;
B.增大压强,化学反应速率加快,平衡正向移动,故B正确;
C.增大O2的浓度,化学反应速率加快,平衡正向移动,故C正确;
D.选择高效催化剂,化学反应速率加快,平衡不移动,故D错误,
故答案为:BC.
点评 本题考查化学反应中能量变化的判断,化学平衡的影响因素和平衡移动方向的判断,化学平衡状态的判断、化学反应速率和化学平衡的影响因素,难度中等.要注意把握平衡状态的特征.


科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 常温常压下,32g氧气(O2)和32g臭氧(O3)都含有2NA个氧原子 | |
| C. | 500mL 0.2 mol/L Na2SO4溶液中含有NA个Na+离子 | |
| D. | 通常状况下,22.4 L的氨气和甲烷含有的电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4V(A)=5V(B) | B. | 5V(B)=6VD | C. | 2V(A)=3VD | D. | 4V(B)=5VC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 HCl Mg(OH)2 MgCl2 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2O HNO3 NaOH KNO3 | D. | SO3 NaHCO3 NaOH Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定能与水反应生成对应的酸,与水反应生成酸的氧化物不一定是酸性氧化物 | |
| B. | 碱性氧化物不一定能与水反应生成对应的碱,与水反应生成碱的氧化物不一定是碱性氧化物 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 部分离子 | Cl- | CO32- | SO42- | NH4+ | Ba2+ |
| c/(mol•L-1) | 无法确定 | 0.2 | 0.1 | 0.4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油 | B. | 电石 | C. | 棉被、衣物 | D. | 过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使蒸发皿盛满滤液,用小火加热 | |
| B. | 等到蒸发皿中出现较多量固体时停止加热 | |
| C. | 待溶液蒸干后,再停止加热 | |
| D. | 将蒸发皿放在石棉网上,用酒精灯加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的比例模型示意图: | |
| B. | HCN分子的结构式:H-C≡N | |
| C. | NaHCO3在水中的电离方程式:NaHCO3?Na++H++CO32- | |
| D. | 铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com