
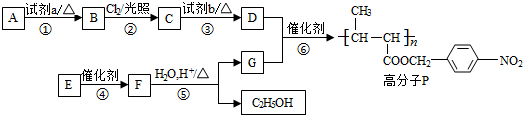
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$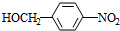 +NaCl.
+NaCl.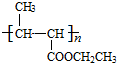 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$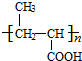 +n CH3CH2OH.
+n CH3CH2OH.
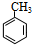
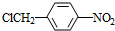
分析 A的分子式是C7H8,其结构简式是 ,结合P的结构简式,可知A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为
,结合P的结构简式,可知A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为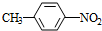 ,B与氯气在光照条件下发生取代反应生成C为
,B与氯气在光照条件下发生取代反应生成C为 ,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为
,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为 ,可知G的结构简式为
,可知G的结构简式为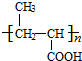 ,则F
,则F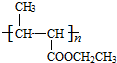 ,E的分子式是C6H10O2,则E为CH3CH=CHCOOCH2CH3.
,E的分子式是C6H10O2,则E为CH3CH=CHCOOCH2CH3.
解答 解:A的分子式是C7H8,其结构简式是 ,结合P的结构简式,可知A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为
,结合P的结构简式,可知A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为 ,B与氯气在光照条件下发生取代反应生成C为
,B与氯气在光照条件下发生取代反应生成C为 ,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为
,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为 ,可知G的结构简式
,可知G的结构简式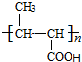 ,则F,E的分子式是C6H10O2,则E为CH3CH=CHCOOCH2CH3.
,则F,E的分子式是C6H10O2,则E为CH3CH=CHCOOCH2CH3.
(1)A的分子式是C7H8,其结构简式是 ,故答案为:
,故答案为: ;
;
(2)试剂a是:浓硫酸和浓硝酸,故答案为:浓硫酸和浓硝酸;
(3)反应③的化学方程式: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$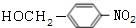 +NaCl,
+NaCl,
故答案为: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl;
(4)E为CH3CH=CHCOOCH2CH3,E中含有的官能团:碳碳双键、酯基,故答案为:碳碳双键、酯基;
(5)反应④的反应类型是:加聚反应,故答案为:加聚反应;
(6)反应⑤的化学方程式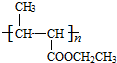 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$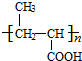 +n CH3CH2OH,
+n CH3CH2OH,
故答案为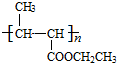 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$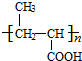 +n CH3CH2OH;
+n CH3CH2OH;
(7)乙烯与HBr发生加成反应生成CH3CH2Br,然后发生水解反应生成CH3CH2OH,再发生氧化反应生成CH3CHO,2分子乙醛发生加成反应生成 ,再发生氧化反应生成
,再发生氧化反应生成 ,再与氢气发生加成反应生成
,再与氢气发生加成反应生成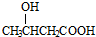 ,在浓硫酸、加热条件下发生消去反应生成生成CH3CH=CHCOOH,最后与乙醇发生酯化反应生成CH3CH=CHCOOCH2CH3,合成路线流程图为:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{OH-}^{CH_{3}CHO}$
,在浓硫酸、加热条件下发生消去反应生成生成CH3CH=CHCOOH,最后与乙醇发生酯化反应生成CH3CH=CHCOOCH2CH3,合成路线流程图为:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{OH-}^{CH_{3}CHO}$ $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$ $→_{催化剂}^{氢气}$
$→_{催化剂}^{氢气}$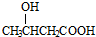 $→_{△}^{浓硫酸}$CH3CH=CHCOOH$→_{浓硫酸/△}^{CH_{2}CH_{2}OH}$CH3CH=CHCOOCH2CH3,
$→_{△}^{浓硫酸}$CH3CH=CHCOOH$→_{浓硫酸/△}^{CH_{2}CH_{2}OH}$CH3CH=CHCOOCH2CH3,
故答案为:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{OH-}^{CH_{3}CHO}$ $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$ $→_{催化剂}^{氢气}$
$→_{催化剂}^{氢气}$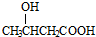 $→_{△}^{浓硫酸}$CH3CH=CHCOOH$→_{浓硫酸/△}^{CH_{3}CH_{2}OH}$CH3CH=CHCOOCH2CH3.
$→_{△}^{浓硫酸}$CH3CH=CHCOOH$→_{浓硫酸/△}^{CH_{3}CH_{2}OH}$CH3CH=CHCOOCH2CH3.
点评 本题考查有机物的推断与合成,充分利用P的结构简式与反应条件、分子式进行推断,侧重考查学生分析推理能力、知识迁移运用能力,是有机化学常考题型,难度中等.


科目:高中化学 来源: 题型:选择题
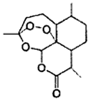 中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )| A. | 青蒿素的分子式是C15H22O5 | B. | 青蒿素在碱性条件下不能稳定存在 | ||
| C. | 青蒿素所有碳原子均在同一平面上 | D. | 青蒿素可以发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AB3是非极性分子 | B. | A原子无孤对电子 | ||
| C. | A原子为sp3杂化 | D. | AB3为三角锥形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
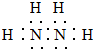 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
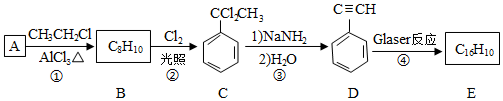
 ,D的化学名称为苯乙炔.
,D的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.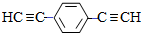 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$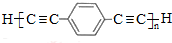 +(n-1)H2.
+(n-1)H2.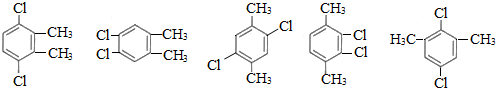 任意三种.
任意三种.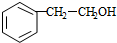 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$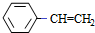 $\stackrel{Br_{2}/H_{2}O}{→}$
$\stackrel{Br_{2}/H_{2}O}{→}$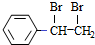 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$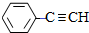 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
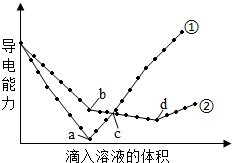 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | c点,两溶液中含有相同量的OH- | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

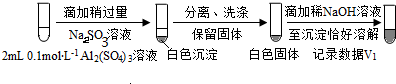
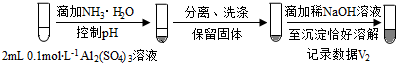 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com