
下列有关仪器使用方法或实验操作正确的是( )
A. 洗净的锥形瓶和容量瓶可以放进烘箱烘干
B. 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
C. 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D. 酸式滴定管装标准溶液前,必须先用标准溶液润洗
科目:高中化学 来源:2017届江西省等六校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列说法都正确的是( )
① 中国有长江、珠江、黄河三角洲,三角洲的形成通常与胶体的性质有关
②“瓦良格”号航母使用了大量特种钢材,钢材是合金,合金是混合物
③ 醋酸为弱酸,一水合氨为弱碱,因此醋酸铵为弱电解质
④氯酸钠是强氧化剂,与有机物混合可形成爆炸混合物,二者应分类、分区存放,氯酸钠与木头、塑料袋、编织袋等有机可燃物不能混放在一起
⑤ 常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
⑥ 水陆两用坦克中,用于密封的橡胶材料是高分子化合物
A. ①②③④ B. ①②④⑥ C. ①②⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.21周考化学卷(解析版) 题型:选择题
下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增加压强 C.升高温度 D.使用正催化剂
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
类比推理是化学中常用的思维方法。下列推理正确的是
A.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
B.SiH4的沸点高于CH4,推测H2S的沸点高于H2O
C.CO2是直线型分子,推测CS2也是直线型分子
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.常温下,0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市苍溪县高三零诊理综化学试卷(解析版) 题型:实验题
里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
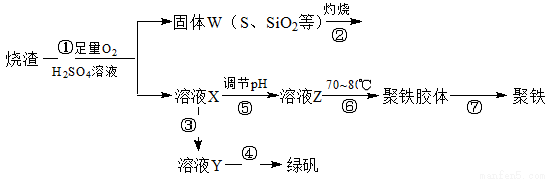
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:___________________。
(2)将过程②中产生的气体通入下列溶液中,溶液会褪色的是_________。
A.品红溶液 B.紫色石蕊试液 C.酸性高锰酸钾溶液 D.溴水
(3)过程③中,需要加入的物质是_______________(化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_____________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是:__________________________。
(6)检验X溶液中的金属阳离子,通常使用的试剂和现象是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO 、Fe2+、NH
、Fe2+、NH 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1molNO 发生氧化反应,则转移电子5mol
发生氧化反应,则转移电子5mol
D.该反应中Fe2+是还原剂,NH 是还原产物
是还原产物
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:填空题
 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

 部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
| Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤液Ⅱ中可回收利用的主要物质有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是__________,若要得到MgCl2应采取的操作是___________。
(5)用稀硫酸酸浸时形成滤渣的离子方程 式有_____________________。
式有_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com