
某种元素原子的质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.由已知信息可得NA=
B.W g该原子的物质的量一定是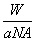 mol
mol
C.W g该原子中含有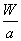 个该原子
个该原子
D.该原子的摩尔质量是aNA g
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
有关A1型密堆积与A3型密堆积的说法中正确的是( )
A.A1型密堆积是最密堆积,A3型密堆积不是最密堆积
B.两者都是最密堆积,其中A3型密堆积是一、三、五……各层球心重合,二、四、六……各层球心重合;A1型密堆积是四、五、六各层球心分别和一、二、三层各球心重合
C.原子晶体一般都采用A1型密堆积或A3型密堆积
D.只有金属晶体才可能采用A1型密堆积或A3型密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。以下是制备它的一种配方中含有的两种物质:
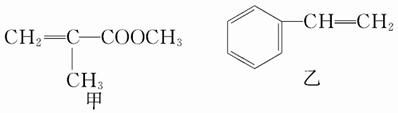
(1)甲中含有的官能团名称为____________。
(2)下列试剂能与甲反应而褪色的是______(填标号)。
a.溴的CCl4溶液 b.石蕊试液
c.酸性KMnO4溶液
(3)甲和乙两种物质均能发生的反应类型是______(填标号)。
a.取代反应 b.加成反应 c.酯化反应
d.加聚反应 e.水解反应 f.氧化反应
(4)写出下列反应的化学方程式:
①乙与溴的四氯化碳溶液反应_____________________;
②甲与NaOH溶液共热的反应______________________;
③由甲生成高分子化合物的反应___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的NH 的数目为0.3NA( )
的数目为0.3NA( )
(2)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA( )
(3)0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA( )
(4)25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA( )
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.常温下,1 L 0.1 mol·L-1 NH4NO3溶液中的氮原子数为0.2NA
B.含有58.5 g氯化钠的溶液中含有NA个氯化钠分子
C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温常压下,22.4 L乙烯中C—H的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,4.0 g CH4中含有共价键的数目为NA
B.常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA
C.常温常压下,22.4 L NH3约含有NA个NH3分子
D.一定条件下6.4 g SO2与足量氧气反应生成SO3,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________________________________________________________________________。
(2)混合气体的平均摩尔质量是________________________________________________________________________。
(3)CO2和CO的体积之比是________________________________________________________________________。
(4)CO的体积分数是________________________________________________________________________。
(5)CO2和CO的质量之比是________________________________________________________________________。
(6)CO的质量分数是________________________________________________________________________。
(7)混合气体中所含氧原子的物质的量是________________________________________________________________________。
(8)混合气体中所含碳原子的物质的量是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用“偏大”、“偏小”或“无影响”填空
(1)配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g________。
(2)配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g________。
(3)配制NaOH溶液时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确________。
(4)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒________。
(5)用量筒量取浓硫酸时,仰视读数________。
(6)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容________。
(7)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线________。
(8)定容摇匀后,发现液面下降,继续加水至刻度线________________________________________________________________________。
(9)定容时仰视刻度线________。
(10)定容摇匀后少量溶液外流________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个电子层且只含1个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D的原子第三电子层上有8个电子,第四电子层上只有1个电子;E原子的外围电子排布式为3s23p6。
(1)写出A、B、C、D四种元素的元素符号:________________________________。
(2)检验某溶液中是否含有D+,可通过________反应来实现;检验某溶液中是否含有B-,通常所用的试剂是__________和__________。
(3)写出E的元素符号________,要证明太阳上是否含有E元素,可采用的方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com