
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 8 | 13 | 17 | |
| 元素符号 | Na | |||
| 周期 | ||||
| 族 |
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子序数 | 8 | 11 | 13 | 17 |
| 元素符号 | Na | Cl | ||
| 周期 | 二 | 三 | ||
| 族 | IA | VIIA |
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
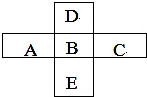 A、B、C、D、E五种主族元素所处周期表的位置如图所示.
A、B、C、D、E五种主族元素所处周期表的位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
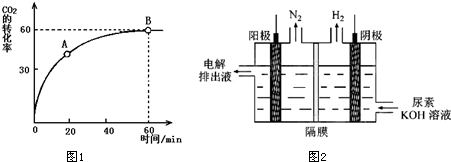
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2作为氧化剂得到的电子数为NA |
| B、在标准状况下,11.2L水中含有分子数为0.5NA |
| C、0.3mol/LNa2SO4溶液中,所含Na+和SO42-总数为0.9NA |
| D、常温压下,64gSO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰和氨都属于弱电解质 |
| B、NO2和SO2都是形成酸雨的气体 |
| C、淀粉、纤维素和油脂都属于天然高分子化合物 |
| D、常温下,铁、铝遇到稀硝酸表面会生成一层致密的氧化膜,发生钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com