
【题目】用下列试剂或方法不能鉴别NaOH溶液和KC1溶液的是
A. 紫色石蕊试液 B. Ba(NO3)2溶液 C. CuCl2溶液 D. 焰色反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质。通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的![]() 为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. ![]() 的氢化物常温常压下为液态
的氢化物常温常压下为液态
D. ![]() 的最高价氧化物的水化物为强酸
的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 钠和冷水反应 2Na+2H2O=2Na++2OH-+H2↑
B. 石灰石与醋酸溶液反应 CaCO3+2H+=Ca2++H2O+CO2↑
C. 溴化亚铁溶液中通入少量氯气 2Br -+ Cl2=Br2+2C1-
D. NH4HCO3 溶液中加入足量的 NaOH 溶液:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
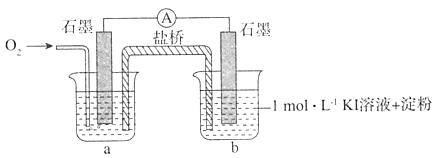
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL硫酸钠中含Na+质量为m g,则
A. m/23V mol/L B.23/mV mol/L C.2m/23 V mol/L D. m/46Vmol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出元素⑩符号:____________;画出原子的结构示意图:⑦___________.
(2)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(3)写出元素④氢化物的电子式:_______________。
(4)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(5)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 以可逆反应为原理的原电池发生反应达平衡时,该电池仍有电流产生
B. 向AgCl、AgBr的饱和溶液中加入少量的AgNO3,溶液中氯离子和溴离子浓度的比值不变
C. 使用催化剂能够降低反应的△H
D. 金属发生吸氧腐蚀时,被腐蚀的速率和氧浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐。已知:亚硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用下图所示仪器(夹持装置已省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃

(1)上述仪器的连接顺序为:A→____→_____→_____→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是____________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
① 依据___________________现象,可确认产物中有NO
② 装置E的作用是_________________。
(4)如果没有装置C,对实验结论的影响是____________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com