
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
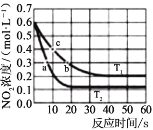
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
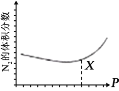
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
【答案】4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) △ H=2△ H3-△ H1-2△ H2 0.01molL-1s-1 0.8 molL-1 增大 NO2 的浓度(其它合理答案均可) 小于 大于 32 增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)①![]() ,利用三段法计算平衡常数;
,利用三段法计算平衡常数;
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采用增大 NO2 的浓度;
③温度由T1到T2时NO2平衡时浓度降低,则平衡正移,![]() ,则T1<T2;
,则T1<T2;
④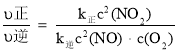 ,再根据平衡常数K和达到平衡时υ正=υ逆计算
,再根据平衡常数K和达到平衡时υ正=υ逆计算![]() ;
;
(3)由化学方程式![]() 可知,正反应为压强增大的反应,则增大压强平衡逆移,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,以此分析。
可知,正反应为压强增大的反应,则增大压强平衡逆移,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,以此分析。
(1)根据盖斯定律可得![]() 可得
可得![]() △ H=2△ H3-△ H1-2△ H2,故答案为:
△ H=2△ H3-△ H1-2△ H2,故答案为:![]() △ H=2△ H3-△ H1-2△ H2;
△ H=2△ H3-△ H1-2△ H2;
(2)①![]() ,由图像可得
,由图像可得

则平衡常数 ,故答案为:0.01molL-1s-1;0.8 molL-1;
,故答案为:0.01molL-1s-1;0.8 molL-1;
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采用增大 NO2 的浓度,故答案为:增大 NO2 的浓度;
③温度由T1到T2时NO2平衡时浓度降低,则平衡正移,则KT1< KT2;![]() ,则T1<T2,相同浓度下温度越高反应速率越快,则υa>υb,故答案为:小于;大于;
,则T1<T2,相同浓度下温度越高反应速率越快,则υa>υb,故答案为:小于;大于;
④当υ正=υ逆时,反应达到平衡,![]() ,则
,则 ,则c 处时各物质浓度如下
,则c 处时各物质浓度如下
则 ,故答案为:32;
,故答案为:32;
(3)由化学方程式![]() 可知,正反应为压强增大的反应,则增大压强平衡逆移,N2 的体积分数减小,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,N2 的体积分数增大,故答案为:增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大。
可知,正反应为压强增大的反应,则增大压强平衡逆移,N2 的体积分数减小,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,N2 的体积分数增大,故答案为:增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大。


科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
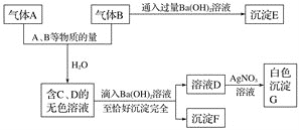
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒沙特列原理解释的是( )
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 棕红色NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 高压比常压有利于NH3的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有__种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为__。
(2)根据铜、锌原子结构可知第二电离能I2(Zn)__I2(Cu)填“大于”或“小于” 。
(3)向蓝色硫酸铜溶液[Cu(H2O)4]2+中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。
①H2O分子中心原子的杂化类型为__;分子中的键角:H2O__NH3(填“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O__NH3(填“大于”或“小于”)。
③氨硼烷(BH3—NH3)可以作为机动车使用的备选氢来源或氢储存的材料。
下列与氨硼烷是等电子体的有__(填编号)。
A.乙烷 B.H2O2 C.H3PO4 D.S8
④写出BH3—NH3的结构式 结构中若含配位键用→表示 __。
(4)某磷青铜晶胞结构如图所示。
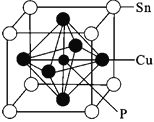
①其化学式为__。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为__cm(用NA表示阿伏加德罗常数,用M表示该晶体的摩尔质量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
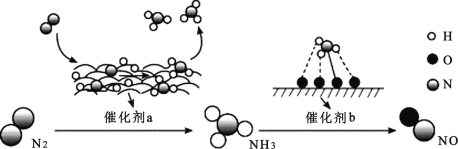
A.催化剂 a 表面发生了共价键的断裂和形成,但分子总数不变
B.在催化剂b 表面形成新的共价键时,存在微粒间的电子转移
C.N2 与H2 反应生成 NH3 的原子利用率不足 100%
D.催化剂 a、b 能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是( )
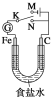
A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D. 若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甘氨酸在水溶液中主要以 、
、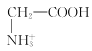 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
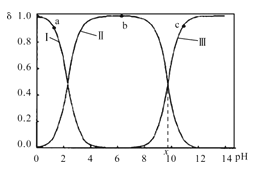
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c( )
)
C.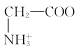 +H2O
+H2O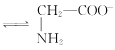 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(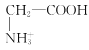 )+c(H+)=c(
)+c(H+)=c(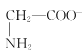 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
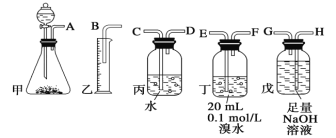
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 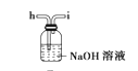
B.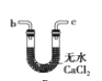
C.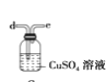
D.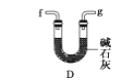
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com