
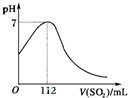
 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH的变化如图所示,则原氢硫酸溶液的物质的量浓度为:( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH的变化如图所示,则原氢硫酸溶液的物质的量浓度为:( )| V |
| Vm |
| n |
| V |
| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 0.1L |


科目:高中化学 来源:学习高手选修化学(反应原理人教版) 人教版 题型:013
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
氯化铵溶液呈酸性 NH |
B. |
氢硫酸电离 H2S |
C. |
向小苏打溶液中加入醋酸溶液 HCO |
D. |
在标准状况下,向10 mL 0.1 mol·L-1 FeBr2溶液中通入22.4 mL Cl2 2Fe2++2Br-+2Cl2 |
查看答案和解析>>
科目:高中化学 来源:江西省上高二中2011-2012学年高二第三次月考化学试题 题型:013
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
氯化铵溶液呈现酸性:NH4+ |
B. |
氢硫酸的电离:H2S |
C. |
向小苏打溶液中加入醋酸溶液:HCO3-+H+ |
D. |
在标准状况下,向10 mL 0.1 mol·L-1的FeBr2溶液中通入22.4 mL Cl2:2Fe2++2Br-+2Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.氯化铵溶液呈酸性 NH![]()
![]() NH3+H+?
NH3+H+?
B.氢硫酸电离 H2S![]() 2H++S2-??
2H++S2-??
C.向小苏打溶液中加入醋酸溶液 HCO![]() +H+
+H+![]() CO2+H2O?
CO2+H2O?
D.在标准状况下,向10 mL 0.1 mol·L-1 FeBr2溶液中通入22.4 mL Cl2 2Fe2++2Br-+2Cl2![]() 2Fe3++Br2+4Cl-?
2Fe3++Br2+4Cl-?
查看答案和解析>>
科目:高中化学 来源: 题型:
A.氯化铵溶液呈酸性![]()
![]() NH3+ H+
NH3+ H+
B.氢硫酸的电离H2S![]() 2 H++S2-
2 H++S2-
C.向小苏打溶液中加入醋酸溶液![]() +H+====CO2+H2O
+H+====CO2+H2O
D.在标准状况下,向10 mL 0.1 m01.L-1 FeBr2溶液中通入22.4 mLCl2
2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com